Bộ 5 đề thi giữa kì 1 Hóa 11 Kết nối tri thức (2023-2024) có đáp án - Đề 4
32 câu hỏi
Hằng số cân bằng của phản ứng thuận nghịch phụ thuộc vào
nhiệt độ.
áp suất.
chất xúc tác.
nồng độ.
Các yếu tố ảnh hưởng đến cân bằng hoá học là
nồng độ, nhiệt độ và chất xúc tác.
nồng độ, áp suất và diện tích bề mặt.
nồng độ, nhiệt độ và áp suất.
áp suất, nhiệt độ và chất xúc tác.
Một cân bằng hóa học đạt được khi
nhiệt độ phản ứng không đổi.
tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
nồng độ chất phản ứng bằng nồng độ sản phẩm.
không có phản ứng xảy ra nữa dù có thêm tác động của các yếu tố bên ngoài.
Cân bằng hóa học là cân bằng
động.
tĩnh.
ổn định.
đều.
Sự phá vỡ cân bằng cũ để chuyển sang một cân bằng mới do các yếu tố bên ngoài tác động được gọi là
sự biến đổi chất.
sự dịch chuyển cân bằng.
sự chuyển đổi vận tốc phản ứng.
sự biến đổi hằng số cân bằng.
Quá trình phân li các chất khi tan trong nước tạo thành các ion gọi là sự
ăn mòn.
điện phân.
li tâm.
điện li.
Chất nào sau đây là chất điện li mạnh?
HF.
2SO3.
Fe(OH)2.
CuSO4.
Đối với dung dịch acid yếu CH3COOH 0,10 M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
[H+] < [CH3COO-].
[H+] > [CH3COO-].
[H+] < 0,10 M.
[H+] = 0,10 M.
Theo thuyết Bronsted – Lowry chất nào sau đây có tính chất lưỡng tính?
SO32-.
CO32-
HCO3-.
NaOH.
Trong phương trình sau: CH3COOH + H2O ⇌ H3O+ + CH3COO-, nước đóng vai trò là
Acid.
Base.
Lưỡng tính.
Trung tính.
Công thức tính pH là
pH = - lg[H+].
pH = lg[H+].
pH = +10lg[H+].
pH = - lg[OH-].
Trong không khí chứa chủ yếu hai khí nào sau đây?
N2, CO2.
CO2, O2.
NH3, O2.
O2, N2.
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
(NH4)3PO4.
NH4HCO3.
CaCO3.
NaCl.
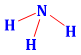
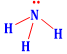
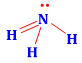
Công thức Lewis của NH3 là
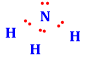 .
.
Nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng các kim loại trong quặng là do nitric acid có tính
acid mạnh.
khử mạnh.
oxi hóa mạnh.
base mạnh.
Số oxi hóa của nguyên tố N trong nitric acid là
+3.
-3.
-1.
+5.
Cho phương trình hoá học: N2 g+O2 g⇌2NO g; > 0. Hãy cho biết những yếu tố nào sau đây ảnh hưởng đến sự chuyển dịch cân bằng hoá học trên?
Nhiệt độ và nồng độ.
Áp suất và nồng độ.
Nồng độ và chất xúc tác.
Áp suất và nhiệt độ.
Cho cân bằng: 2SO2 (g) + O2 (g) ⇋ 2SO3 (g). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng?
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Xét cân bằng: Fe2O3(s) + 3CO(g) ⇌ 2Fe(s) + 3CO2(g). Biểu thức hằng số cân bằng của hệ là
KC = Fe2CO23Fe2O3CO3.
KC = Fe2O3CO3Fe2CO23.
KC = CO3CO23 .
KC = CO2 3CO 3.
pH của dung dịch nào sau đây có giá trị lớn nhất?
Dung dịch HNO3 0,1M.
Dung dịch HF 0,1M.
Dung dịch KCl 0,1M.
Dung dịch KOH 0,01M.
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH. Giá trị nồng độ của dung dịch HCl trên là
0,5 M.
0,15 M.
0,2 M.
0,25 M.
Trong các dung dịch sau, dung dịch nào làm quỳ tím hóa xanh?
NaCl.
K2SO3.
FeCl3.
K2SO4.
Trong những nhận xét dưới đây, nhận xét nào là đúng khi nói về nitrogen?
Nitrogen không duy trì sự cháy, sự hô hấp và là một khí độc.
Vì có liên kết 3 nên phân tử nitrogen rất bền và ở nhiệt độ thường nitrogen khá trơ về mặt hóa học.
Khi tác dụng với khí hydrogen, nitrogen thể hiện tính khử.
Số oxi hóa của nitrogen trong các hợp chất và ion AlN, N2O4, NH4+, NO3-, NO2-, lần lượt là -3, +4, -3,+5,+4.
Trong y học, vì sao nitrogen lỏng được dùng để bảo quản mẫu vật do nitrogen
không duy trì sự hô hấp và tạo môi trường trơ.
là chất khí không màu, không mùi, không vị.
tan ít rất trong nước.
hóa lỏng ở nhiệt độ thấp.
Tính base của ammonia được thể hiện qua phản ứng nào sau đây?
NH3 + HCl → NH4Cl.
2NH3 + 3Cl2 N2 + 6HCl.
4NH3 + 3O2 4N2 + 6H2O.
2NH3 + 3CuO 3Cu + 2N2 + CuO.
Nhận biết dung dịch chứa ion NH4+ là ta dùng dung dịch
NaOH.
BaCl2.
HCl.
Ba(NO3)2.
Dãy gồm tất cả các chất khi tác dụng với HNO3 thì HNO3 chỉ thể hiện tính axit là
CaCO3, Cu(OH)2, Fe3O4, KI.
CuO, NaOH, FeCO3, Fe2O3.
Fe(OH)3, Na2CO3, Fe2O3, K2SO3.
KOH, FeS, K2CO3, Cu(OH)2.
Các khí thải công nghiệp và của các động cơ ô tô, xe máy… là nguyên nhân chủ yếu gây ra mưa axit.
Thành phần hóa học chủ yếu trong khí thải trực tiếp gây ra mưa axit là
NO, NO2, SO2.
N2O, NO2, SO2.
N2. NO2, SO2.
N2O5, NO2, SO2.
(1,0 điểm): Trộn 200 mL dung dịch gồm KOH 0,02 M và NaOH 0,01 M với 200 mL dung dịch H2SO4 0,005 M thu được dung dịch X.
(a) Tính pH của dung dịch thu được?
(b) Dung dịch trên có môi trường gì?
(c) Hãy cho biết khi nhúng quỳ tím vào dung dịch trên thì quỳ tím có màu gì?
(1,0 điểm): Hoàn thành các phương trình phản ứng hóa học sau:
(1) N2 + O2 (2) NH3 + HNO3 →
(3) NH4NO3 (4) Fe + HNO3(đặc)
(0,5 điểm): Nêu các biện pháp nhằm hạn chế hiện tượng phú dưỡng xảy ra ở các ao, hồ.
(0,5 điểm): Từ hỗn hợp khí N2 và H2 (tỉ lệ mol N2 : H2 = 1 : 3), xúc tác thích hợp thu 51 gam NH3. Biết hiệu suất phản ứng là 25%. Tính thể tích hỗn hợp N2 và H2 phản ứng ở đkc.
Cho biết: H = 1, N = 14.








