Bộ 5 đề thi giữa kì 1 Hóa 11 Kết nối tri thức (2023-2024) có đáp án - Đề 3
31 câu hỏi
Phản ứng thuận nghịch là phản ứng
trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau.
chỉ xảy ra theo một chiều nhất định.
xảy ra giữa hai chất khí.
có phương trình hóa học được biểu diễn bằng mũi tên một chiều.
Phản ứng nào sau đây là phản ứng một chiều?
N2(g) + 3H2(g) 2NH3(g).
CaCO3(s) CaO(s) + CO2(g).
2SO2(g) + O2(g) 2SO3(g).
NH3 +HNO3 NH4NO3.
Biểu thức hằng số cân bằng của phản ứng: H2(g) + I2(g) 2HI(g) là:
KC = .
KC = .
KC =.
KC = .
Mối quan hệ giữa tốc độ phản ứng thuận (vt) và tốc độ phản ứng nghịch (vn) ở trạng thái cân bằng được biểu diễn như thế nào?
vt = 2vn.
vt = vn = 0.
vt = vn 0.
vt = 0,5vn.
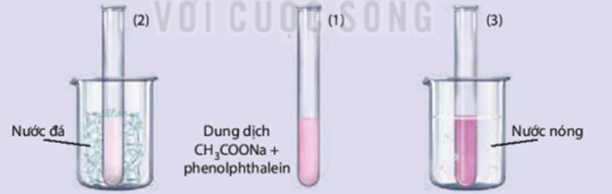
Có 3 ống nghiệm chứa đầy khí NO2 có màu nâu đỏ, ống (1) để so sánh. Nếu ta ngâm ống nghiệm (2) vào cốc nước đá khoảng 2 phút thì màu nâu đỏ trong ống nghiệm nhạt dần. Nếu ta ngâm ống nghiệm (3) vào cốc nước nóng sau 2 phút thì màu nâu đỏ trong ống nghiệm tăng dần (hình dưới).

Hãy cho biết yếu tố nào đã làm chuyển dịch cân bằng 2NO2(g) N2O4(g) nói trên?
Nồng độ.
Nhiệt độ.
Áp suất.
Nhiệt độ và áp suất.
Cho một vài giọt phenolphtalein vào dung dịch CH3COONa, lắc đều dung dịch có màu hồng nhạt.
Chia dung dịch thu được vào 3 ống nghiệm với thể tích gần bằng nhau: ống (1) để so sánh, ống (2) thêm vài tinh thể CH3COONa, ống (3) thêm vài giọt dung dịch CH3COOH. Ta thấy ống (2) màu hồng đậm lên, ống (3) màu hồng nhạt đi (hình dưới).
Hãy cho biết yếu tố nào sau đây đã làm chuyển dịch cân bằng CH3COONa + H2O CH3COOH + NaOH trong ông nghiệm nói trên?
Áp suất.
Nhiệt độ.
Nhiệt độ và áp suất.
Nồng độ.
Sự điện li là
quá trình phân li các chất khi tan trong nước thành các phân tử nhỏ hơn.
quá trình hòa tan các chất trong nước.
quá trình phân li các chất khi tan trong nước thành các chất đơn giản
quá trình phân là các chất khi tan trong nước thành các ion.
Chất nào sau đây không phải chất điện li?
BaCl2.
2H5OH.
NaOH.
CH3COOH.
Chất nào sau đây thuộc loại chất điện li mạnh?
CH3COOH.
2O.
2H5OH.
KCl.
Dung dịch chất nào sau đây có pH >7?
NaNO3.
KOH.
2SO4.
KCl.
Câu nào sai khi nói về pH của dung dịch ở 250C?
[H+] =10–pH.
[H+].[OH–]=10–14.
pH của nước cất = 7.
pH = lg[H+].
Lấy 10 ml dung dịch KOH rồi chuẩn độ bằng dung dịch HCl 1M thì dùng hết 20 ml dung dịch HCl. Nồng độ dung dịch KOH đã chuẩn độ là
1,5M.
1M.
0,5M.
2M.
Phương pháp chuẩn độ là phương pháp
xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
xác định nồng độ của một chất bằng sự thay đổi màu sắc của các chỉ thị.
xác định nồng độ của một chất bằng một dung dịch chuẩn chưa biết nồng độ.
xác định nồng độ của một chất bằng sự thay đổi màu sắc của dung dịch chuẩn.
Cho phương trình: NH3 + H2O NH + OH.
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là acid?
H₂O.
NH3.
NH.
OH.
Hoa đậu biếc thuộc họ đậu, sống dây leo, thường sử dụng làm chất tạo màu tự nhiên. Người ta thường đun sôi hoa đậu biếc với nước, màu hoa sẽ được trích ly tạo thành màu xanh biếc. Ở mỗi trường pH < 7 (môi trường acid), nước hoa đậu biếc chuyển sang đỏ tím, khi môi trường pH ≥ 7 nó chuyển sang màu xanh thẫm.
Trộn lẫn 20 ml dung dịch NaOH 0,01M với 20 ml dung dịch HCl 0,03 M được dung dịch Y. Khi cho nước hoa đậu biếc vào dung dịch Y thì dung dịch Y có màu
vàng.
đỏ tím.
tím.
xanh.
Trong tự nhiên, nitrogen tồn tại ở dạng
đơn chất N2 và các hợp chất.
đơn chất N2.
hợp chất nitrate.
hợp chất NH3.
Tại sao nitrogen lỏng được dùng để bảo quản mẫu vật phẩm trong y học?
Nitrogen hoá long ở nhiệt độ thấp, -196 C.
Nitrogen lỏng dễ sản xuất và có giá thành rẻ.
Nitrogen lỏng có tính khử mùi.
Nitrogen lỏng thân thiện với môi trường.
Ở nhiệt độ thường, khí N2 khá trơ về mặt hóa học. Nguyên nhân là do
nguyên tử nitrogen có độ âm điện kém hơn oxi.
trong phân tử N2 có liên kết ba rất bền.
trong phân tử N2, mỗi nguyên tử nitrogen còn 1 cặp electron chưa tham gia liên kết.
nguyên tử nitrogen có bán kính nhỏ.
Cho hình vẽ mô tả thí thí nghiệm như sau:
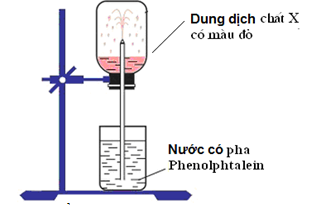
Hình vẽ mô tả thí nghiệm để chứng minh
tính base của NH3.
tính tan nhiều trong nước của NH3.
tính khử của NH3.
tính tan nhiều trong nước và tính base của NH3.
Dạng hình học của phân tử ammonia là
đường thẳng.
hình chóp tam giác.
hình tam giác đều.
hình tứ điện đều.
Công thức Lewis của NH3 là:
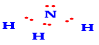
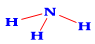
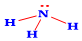
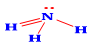
Ứng dụng nào sau đây không phải của muối ammonium?
Làm chất phụ gia thực phẩm.
Điều chế ammonia.
Làm thuốc long đờm, thuốc bổ sung chất điện giải.
Làm phân bón hóa học.
Để tạo độ xốp cho một số loại bánh, người ta có thể dùng muối nào sau đây làm bột nở?
CaCO3.
(NH4)2SO4.
NH4NO2.
NH4HCO3.
Chọn câu sai khi nói về muối ammonium?
Trong phân tử muối ammonium có chứa ion NH.
Muối ammonium rất bền với nhiệt.
Hầu hết các muối ammonium dễ tan trong nước.
Các muối ammonium là chất điện ly mạnh.
Các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ đã phát sinh ra tác nhân chính nào sau đây gây nên hiện tượng mưa acid?
SO2.
CO2.
NOx.
NOx và SO2.
Trong phân tử HNO3,nguyên tử N có
hoá trị V, số oxi hoá +5.
hoá trị IV, số oxi hoá +3.
hoá trị V, số oxi hoá +4.
hoá trị IV, số oxi hoá +5.
Các tính chất hoá học đặc trưng của dung dịch HNO3 là
tính acid mạnh và tính oxi hóa mạnh.
tính acid yếu và tính oxi hóa yếu.
tính acid mạnh và tính khử mạnh.
tính base mạnh và tính oxi hóa mạnh.
(1 điểm) Cho cân bằng hóa học 2SO2(g) + O2(g) 2SO3(g) = -198 kJ.
(a) Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nào? Giải thích.
(b) Nếu tăng áp suất và giữ nguyên nhiệt độ thì cân bằng trên chuyển dịch theo chiều nào? Giải thích?
(1 điểm) Hãy mô tả đặc điểm của ao, hồ có hiện tượng phú dưỡng và để xuất 4 giải pháp để cải tạo.
Chọn phát biểu đúng trong số các phát biểu sau đây?
Dung dịch có pH < 7 làm quỳ tím hóa xanh.
Giá trị pH tăng thì độ acid tăng.
Dung dịch có pH > 7 làm quỳ tím hóa đỏ.
Giá trị pH tăng thì độ acid giảm.
(1 điểm) Phèn chua có công thức hóa học là K2SO4.Al2(SO4)3.24H2O. Từ xưa, phèn chua được sử dụng để lọc nước sinh hoạt, nhất là ở vùng bị lũ lụt. Vậy bằng kiến thức hóa học, em giải thích hiện tượng này?








