Bộ 3 đề thi giữa kì 1 Hóa 11 Kết nối tri thức cấu trúc mới có đáp án - Đề 1
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là
nồng độ, nhiệt độ và chất xúc tác.
nồng độ, áp suất và chất xúc tác.
nồng độ, nhiệt độ và áp suất.
áp suất, nhiệt độ và chất xúc tác.
Biểu thức tính hằng số cân bằng của phản ứng: CaO(s) + CO2(g) CaCO3(s) là
\[{K_C} = \frac{{[CaC{O_3}]}}{{[CaO].[C{O_2}]}}\]
\[{K_C} = \frac{{[CaO].[C{O_2}]}}{{[CaC{O_3}]}}\]
\[{K_C} = [C{O_2}]\]
\[{K_C} = \frac{1}{{[C{O_2}]}}\]
Cho cân bằng hóa học: CaCO3 (s) CaO (s) + CO2 (g)
Biết phản ứng thuận là phản ứng thu nhiệt. Tác động nào sau đây vào hệ cân bằng để cân bằng đã cho chuyển dịch theo chiều thuận?
Tăng nồng độ khí CO2.
Tăng áp suất.
Giảm nhiệt độ.
Tăng nhiệt độ.
Phát biểu nào sau đây đúng khi nói về sự điện li?
Sự điện li là quá trình phân li một chất trong nước thành ion.
Sự điện li quá trình hòa tan một chất vào nước tạo thành dung dịch.
Sự điện li quá trình phân li một chất dưới tác dụng của dòng điện.
Sự điện li thực chất là quá trình oxi hóa – khử.
Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong (1) … vào dung dịch đựng trong bình tam giác. Dụng cụ cần điền vào (1) là
Bình định mức.
Burette.
Pipette.
Ống đong.
Phương trình điện li viết đúng là
\[{H_2}S{O_4} \to 2{H^ + } + {\rm{ }}SO_4^ - \]
NaOH Na+ + OH−
HF H+ + F−
AlCl3 → Al3+ + Cl3−
Trong phản ứng sau đây:
Những chất nào đóng vai trò là acid theo thuyết Bronsted – Lowry?
H2S và H2O
H2S và H3O+
H2S và HS−
H2O và H3O+
Giá trị pH của dung dịch NaOH 0,1 M là
1.
13.
11.
3.
Trong tự nhiên, đơn chất nitrogen có nhiều trong
nước biển.
không khí.
cơ thể người.
mỏ khoáng.
Trong phản ứng: N2(g) + 3H2(g) 2NH3(g). N2 thể hiện
tính khử.
tính oxi hóa.
tính base.
tính acid.
Dạng hình học của phân tử ammonia là
hình tam giác đều.
hình tứ diện.
đường thẳng.
hình chóp tam giác.
Dung dịch NH3 phản ứng được với dung dịch nào sau đây?
NaOH.
KCl.
HCl.
KOH.
Phát biểu nào sau đây không đúng?
Muối ammonium dễ tan trong nước.
Muối ammonium là chất điện li mạnh.
Muối ammonium kém bền với nhiệt.
Dung dịch muối ammonium có tính chất base.
Muối nào sau đây tan nhiều trong nước?
AgCl.
(NH4)2SO4.
CaCO3.
BaSO4.
Trong phân tử HNO3, nguyên tử N có số oxi hóa là
+5.
+3.
+4.
−3.
Nhóm các kim loại đều không phản ứng được với HNO3?
Al, Fe.
Au, Pt.
Al, Au.
Fe, Pt.
Hợp chất nào của nitrogen không được tạo ra khi cho HNO3 tác dụng với kim loại?
NO.
NH4NO3.
NO2
N2O5.
Cho Cu phản ứng với dung dịch HNO3 loãng, nóng thu được một chất khí không màu hóa nâu trong không khí, khí đó là
NO.
N2O.
N2.
NH3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Ammonia là một hợp chất của nitrogen và hydrogen, có rất nhiều ứng dụng trong đời sống và sản xuất.
a. Trong điều kiện thường, NH3 là khí không màu, mùi khai.
b. Khí NH3 nặng hơn không khí.
c. Khí NH3 dễ hoá lỏng, tan nhiều trong nước.
d. Liên kết giữa N và 3 nguyên tử H là liên kết cộng hoá trị có cực.
Cho các chất: NaOH, CH3COOH, HCl, CO2, NaHCO3, C2H5OH.
a. Có 3 chất điện li mạnh là NaOH, HCl, NaHCO3.
b. Có 2 chất điện li yếu là CH3COOH, CO2.
c. Có 1 chất không điện li là C2H5OH.
d. Phương trình điện li của CH3COOH là CH3COOH → CH3COO− + H+.
Cho phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) 2NH3(g)
a. Phản ứng trên có phản ứng thuận là phản ứng tỏa nhiệt.
b. Khi tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều nghịch.
c. Khi giảm áp suất của hệ thì cân bằng chuyển dịch theo thuận.
d. Thực tế để phản ứng tổng hợp NH3 đạt hiệu suất cao thì người ta thực hiện ở nhiệt độ phòng và áp suất cao.
Nitric acid tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm.
a. Nitric acid là một trong các acid mạnh.
b. Nitric acid là một trong các acid có tính khử mạnh.
c. Nitric acid tinh khiết kém bền.
d. HNO3 oxi hoá được hầu hết các kim loại, trừ Au, Pt…
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Sulfur trioxide được tạo thành bằng cách oxi hóa sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450 oC – 500 oC, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hóa học:
Cân bằng hóa học sẽ chuyển dịch theo chiều nào khi tăng nhiệt độ của hệ phản ứng?
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 15 mL dung dịch NaOH. Nồng độ của dung dịch HCl trên là?
Hỗn hợp \({\rm{X}}\) gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450oC có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Hiệu suất của phản ứng tổng hợp NH3 là?
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Các hệ số a, b, c, d, e là những số nguyên đơn giản nhất. Tổng (a + b) bằng bao nhiêu?
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng nào trong các nguồn nước?
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như các hình vẽ dưới đây:
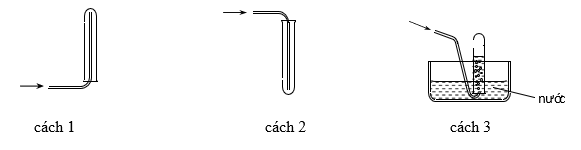
Có thể dùng cách nào trong 3 cách trên để thu khí NH3?








