Bộ 3 đề thi giữa kì 1 Hóa 11 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
21 câu hỏi
Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là
nồng độ, nhiệt độ và chất xúc tác.
nồng độ, áp suất và chất xúc tác.
nồng độ, nhiệt độ và áp suất.
áp suất, nhiệt độ và chất xúc tác.
Cho phản ứng thuận nghịch: . Hằng số cân bằng của phản ứng trên là
\({K_C} = \frac{{{{[S{O_3}]}^2}}}{{{{[S{O_2}]}^2}.[{O_2}]}}\).
\({K_C} = \frac{{[S{O_3}]}}{{[S{O_2}].[{O_2}]}}\).
\({K_C} = \frac{{{{[S{O_2}]}^2}.[{O_2}]}}{{{{[S{O_3}]}^2}}}\).
\({K_C} = \frac{{[S{O_2}].[{O_2}]}}{{[S{O_3}]}}.\)
Cho hệ cân bằng trong một bình kín: N2 (g) + O2 2NO (g); . Cân bằng trên chuyển dịch theo chiều thuận khi nào?
Tăng nhiệt độ của hệ.
Giảm áp suất của hệ.
Thêm khí NO vào hệ.
Thêm chất xúc tác vào hệ.
Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
MgCl2.
HClO3.
Ba(OH)2.
C6H12O6 (glucose).
Trong dung dịch acetic acid (bỏ qua sự phân li của H2O) có những phần tử nào?
H+, CH3COO−.
H+, CH3COO−, H2O.
CH3COOH, H+, CH3COO−, H2O.
CH3COOH, CH3COO−, H+.
Theo thuyết Bronsted – Lowry chất (phân tử/ ion) nào sau đây là acid?
NaOH.
NaCl.
Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là
NO.
Phân biệt được đung dịch \({\rm{N}}{{\rm{H}}_4}{\rm{Cl}}\) và \({\rm{NaCl}}\) bằng thuốc thử là dung dịch
\({\rm{KCl}}\).
\({\rm{KN}}{{\rm{O}}_3}\).
\({\rm{KOH}}\).
\({{\rm{K}}_2}{\rm{S}}{{\rm{O}}_4}\).
Chất có thể dùng để làm khô khí NH3 là
H2SO4 đặc.
P2O5.
CuSO4 khan.
KOH rắn.
Nhận định nào sau đây về phân tử ammonia không đúng?
Phân cực mạnh.
Có một cặp electron không liên kết.
Có độ bền nhiệt rất cao.
Có khả năng nhận proton.
Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hoà trong nước). Hai tác nhân chính gây mưa acid là
\({\rm{C}}{{\rm{l}}_2},{\rm{HCl}}\).
\({{\rm{N}}_2},{\rm{N}}{{\rm{H}}_3}\).
\({\rm{S}}{{\rm{O}}_2},{\rm{N}}{{\rm{O}}_x}\).
\({\rm{S}},{{\rm{H}}_2}S\).
Cho dung dịch \({\rm{HN}}{{\rm{O}}_3}\) tác dụng với các chất sau: \({\rm{N}}{{\rm{H}}_3},{\rm{CaC}}{{\rm{O}}_3},{\rm{Ag}},{\rm{NaOH}}\). Số phản ứng trong đó \({\rm{HN}}{{\rm{O}}_3}\) đóng vai trò acid theo thuyết Brønsted – Lowry là
4.
1.
3.
2.
Cho hai phản ứng:
Xét theo thuyết acid – base của Bronsted – Lowry.
a. Trong phản ứng thuận của phản ứng (1) thì là base, H2O là acid.
b. Trong phản ứng thuận của phản ứng (2) thì là acid, H2O là base.
c. vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
d. H2O vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
Khi nước thải sinh hoạt chứa một lượng lớn ion ammonium thải vào ao, hồ sẽ xảy ra quá trình oxi hoá ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hoà tan trong nước, gây ngạt cho sinh vật sống dưới nước. Nên cần phải có biện pháp phù hợp để xử lý sự ô nhiễm này.
a. Người ta có thể xử lí nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia, rồi chuyển tiếp ammonia thành nitrogen không độc.
b. Quá trình xử lý có thể dùng hóa chất rẻ tiền như bằng nước vôi trong Ca(OH)2.
c. Có thể chuyển ion ammonium thành ammonia bằng khí oxygen.
d. Có thể chuyển ammonia thành nitrogen bằng
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 15 mL dung dịch NaOH. Nồng độ của dung dịch HCl là bao nhiêu M?
Cho các phát biểu sau về khí nitrogen:
(a) Trong không khí, N2 chiếm khoảng 78% về thể tích.
(b) Phân tử N2 có chứa liên kết ba bền vững nên N2 trơ về mặt hóa học ngay cả khi đun nóng.
(c) Trong phản ứng giữa N2 và H2 thì N2 vừa là chất oxi hóa, vừa là chất khử.
(d) N2 lỏng có nhiệt độ thấp nên thường được sử dụng để bảo quản thực phẩm.
(e) Phần lớn N2 được sử dụng để tổng hợp NH3 từ đó sản xuất nitric acid, phân bón, ...
Số phát biểu đúng là bao nhiêu?
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như các hình vẽ dưới đây:
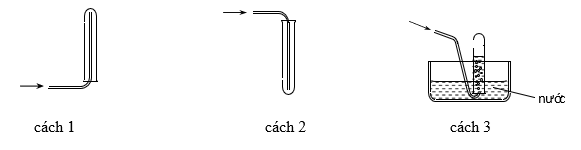
Có thể dùng cách số mấy trong 3 cách trên để thu khí NH3?
Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của \(\mathop N\limits^{ + 5} \)). Giá trị của x là?
Cho a lít dung dịch KOH có pH = 12 vào 8 lít dung dịch HCl có pH = 3 thu được dung dịch Y có pH = 11. Giá trị của a là bao nhiêu?
Trong công nghiệp thực phẩm, nitrogen lỏng (D = 0,808 g/mL) được phun vào vỏ bao bì trước khi đóng nắp để làm căng vỏ bao bì. Thể tích khí nitrogen thu được (đkc) khi hóa hơi 1 mL nitrogen lỏng là bao nhiêu mL? (Kết quả làm tròn đến hàng phần mười)
Hỗn hợp khí X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng X trong bình kín có bột Fe xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Hiệu suất của phản ứng tổng hợp NH3 là?








