Bộ 3 đề thi cuối kì 1 Hóa 10 Cánh diều cấu trúc mới có đáp án - Đề 1
14 câu hỏi
Trong bảng tuần hoàn các nguyên tố hóa học, tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron gọi là
ô nguyên tố.
nhóm.
chu kì.
dãy nguyên tố.
Trong nguyên tử, hạt nào không mang điện tích?
Proton.
Electron.
Neutron.
Neutron và proton.
Nguyên tử khối là
khối lượng tuyệt đối của một nguyên tử.
khối lượng tương đối của một nguyên tử.
tổng số hạt proton, neutron và electron trong nguyên tử.
tổng số proton và electron trong nguyên tử.
Nguyên tử Iron (Fe) có Z = 26. Cấu hình electron của nguyên tử Fe là
[Ar]4s23d6.
[Ar]3d6.
[Ar]3d64s2.
[Ar]4s2.
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng
tăng dần.
giảm dần.
không thay đổi.
giảm sau đó tăng dần.
Phân tử nào sau đây chứa nguyên tử không tuân theo quy tắc octet?
Biết: H (Z = 1), B (Z = 5), C (Z = 6), N (Z = 7), O (Z = 8).
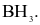
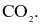
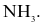
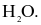
Liên kết ion có bản chất là
sự dùng chung các electron.
lực hút tĩnh điện của các ion mang điện tích trái dấu.
lực hút tĩnh điện giữa cation kim loại với các electron tự do.
lực hút giữa các phân tử.
Nguyên tử của nguyên tố chlorine có Z = 17. Hydroxide cao nhất của nguyên tố này có
tính acid mạnh.
tính acid yếu.
tính base mạnh.
tính base yếu.
Các nguyên tố F, Cl, Br và I đều thuộc nhóm VIIA và ở các chu kì tương ứng là 2, 3, 4 và 5. Dựa vào độ âm điện, liên kết cộng hoá trị trong phân tử HX (X là F, Cl, Br, I) nào phân cực mạnh nhất?
HF.
HCl.
HBr.
HI.
Giữa các nguyên tử khí hiếm Ar, có thể hình thành loại liên kết hay tương tác hoá học nào?
Liên kết ion.
Liên kết cộng hoá trị.
Liên kết hydrogen.
Tương tác van der Waals.
Ion X- có cấu hình electron là 1s22s22p6, nguyên tử Y có số electron ở các phân lớp s là 5. Liên kết giữa X và Y thuộc loại liên kết nào sau đây?
cộng hóa trị phân cực.
cho nhận.
ion.
cộng hóa trị.
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
3.
6.
5.
4.
X là nguyên tố chu kì 2, phân lớp ngoài cùng của nguyên tử nguyên tố X có 3 electron độc thân. Mỗi phát biểu sau là đúng hay sai?
a. Số electron lớp ngoài cùng của X là 3.
b. X là nguyên tố nhóm IIIA hoặc IIIB.
c. X là một kim loại.
d. Số electron lớp ngoài cùng của X là 5.
Phân tử có cấu tạo như sau:
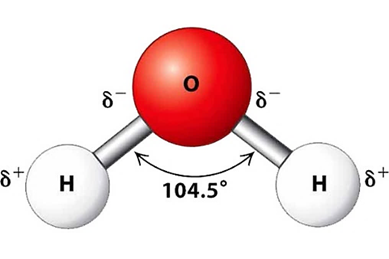
a. Liên kết H–O là liên kết cộng hoá trị không phân cực.
b. Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
c. Nguyên tử O còn một cặp electron hoá trị riêng.
d. Các phân tử H2O có khả năng tạo liên kết hydrogen với nhau.