Bộ 5 đề thi giữa kì Hóa 10 Cánh diều (2023-2024) có đáp án - Đề 2
32 câu hỏi
Khi biết số hiệu nguyên tử là biết được?
Nguyên tử khối.
Số proton.
Số khối.
Số neutron.
Nguyên tử fluorine (F) có 9 proton, 9 electron và 10 neutron. Nguyên tử khối của nguyên tử fluorine là bao nhiêu amu?
9.
19.
18.
28.
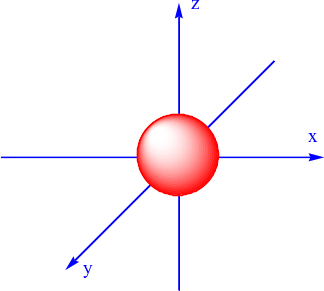
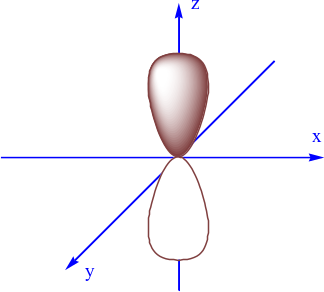
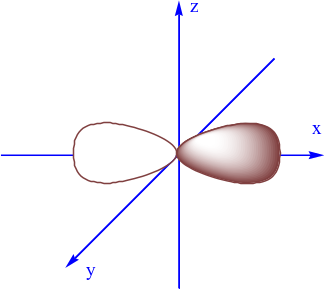
AO nào sau đây là AO s?
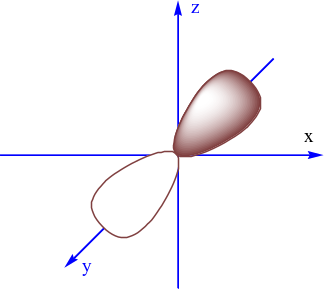
Cho nguyên tử nitrogen (Z = 7), tổng số AO chứa electron trong nguyên tử nitrogen và số electron trong phân lớp 2p lần lượt là
5 và 3.
3 và 4.
2 và 3.
3 và 2.
Ở trạng thái cơ bản, số electron độc thân trong nguyên tử nitrogen (z = 7) là
3
4
2
1
Mendeleev sắp xếp các nguyên tố vào bảng tuần hoàn dựa trên
mối liên hệ giữa khối lượng nguyên tử và tính chất các nguyên tố tương ứng.
tên gọi của các nguyên tố hóa học.
thời điểm khám phá ra nguyên tố hóa học.
mối liên hệ giữa số hiệu nguyên tử và tính chất các nguyên tố tương ứng.
Chọn phát biểu đúng?
Khối lượng của 2 hạt neutron là 1 amu.
Khối lượng của 1 nguyên tử Hydrogen (1proton, 1neutron, 1electron) là 1 amu.
Khối lượng của 2 hạt proton là 1 amu.
Khối lượng của 1 hạt electron là 0,00055 amu.
Nguyên tố hoá học là những nguyên tử có cùng
số proton và số neutron.
số khối A.
số neutron.
số proton.
Kích thước của hạt nhân nguyên tử
bằng một nữa nguyên tử.
gần bằng với kích thước nguyên tử.
bằng kích thước nguyên tử.
bằng khoảng 10-5 đến 10-4 lần kích thước nguyên tử.
Hạt mang điện trong nhân nguyên tử là:
Neutron.
Proton và electron.
Proton.
Electron.
Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là:
Electron và neutron.
Electron và proton.
Electron, proton và neutron.
Proton và neutron.
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
.
.
.
.
Tổng số electron trong các phân lớp s của nguyên tử X là 6. Cấu hình electron của X là
1s22s22p63s23p64s2.
1s22s22p63s23p64s1.
1s22s22p6.
1s22s22p63s23p5.
Lớp M (n = 3) có bao nhiêu AO?
9.
1.
16.
4.
Obital nguyên tử là khu vực không gian xung quanh……..mà xác suất có mặt electron trong khu vực đó là lớn nhất. Điền vào chổ trống cụm từ thích hợp?
phân tử
nguyên tử
lớp vỏ
hạt nhân
Mô hình cấu tạo ở hình dưới đây thuộc về nguyên tử của nguyên tố nào?
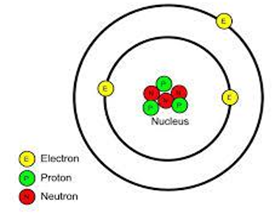
Carbon (Z = 6).
Hydrogen (Z = 1).
Lithium (Z = 3).
Aluminium (Z = 13).
Nội dung nào dưới đây không phải là đối tượng nghiên cứu của hóa học?
Thành phần cấu trúc của chất.
Ứng dụng của chất.
Lai tạo giống cây trồng.
Tính chất và sự biến đổi của chất.
Cấu hình electron của nguyên tử Y như sau: 1s22s22p63s23p3. Số lớp electron và số electron lớp ngoài cùng của Y lần lượt là
3 và 3.
5 và 3.
3 và 5.
2 và 3.
Điểm khác biệt cơ bản giữa mô hình nguyên tử hiện đại và mô hình theo Rutherford-Bohr?
Năng lượng của electron phụ thuộc vào khoảng cách của electron tới hạt nhân nguyên tử.
Các electron ở gần nhân có mức năng lượng thấp hơn các electron ở xa nhân.
Các electron chuyển động xung quanh hạt nhân không theo quĩ đạo xác định.
Khối lượng nguyên tử tập trung ở hạt nhân nguyên tử.
Chỉ ra phát biểu không đúng?
Lớp K có 2 phân lớp.
Lớp thứ n có n phân lớp (với n ≤ 4).
Lớp N có 4 phân lớp.
Lớp M có 3 phân lớp.
Các đồng vị của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về số
obitan.
proton.
electron.
neutron.
Đối tượng nghiên cứu của hóa học là
tốc độ của ánh sáng trong chân không.
chất và sự biến đổi của chất.
lịch sử phát triển của loài người.
sự hình thành hệ mặt trời.
Nguyên tử của nguyên tố X có số hiệu nguyên tử là 9, 2 lớp electron, 7 electron lớp ngoài cùng. Vị trí của X trong bảng tuần hoàn là
ô 7, chu kì 2, nhóm VIIA.
ô 9, chu kì 2, nhóm VIIA.
ô 9, chu kì 3, nhóm VIIA.
ô 9, chu kì 2, nhóm VA.
Phân lớp nào sau đây viết không đúng?
1s
2d
2s
4f
Chọn phát biểu đúng trong các phát biểu sau:
Các nguyên tố nhóm A chỉ có loại nguyên tố s.
Nhóm IA và nhóm IIA là nhóm các nguyên tố s.
Các nhóm B gồm các nguyên tố f.
Họ Lanthanides và Actinides gồm các nguyên tố d.
Cấu hình electron của X là: 1s22s22p63s23p6. X thuộc
ô 18, chu kì 3, nhóm VIIIB.
ô 20, chu kì 3, nhóm VIIIA.
ô 18, chu kì 3, nhóm VIIIA.
ô 18, chu kì 6, nhóm VIIIA.
Cấu hình đúng của nguyên tử Sodium (Z = 11) là
1s1
1s22s22p63s1
1s22s1
1s22s22p1
(1 điểm)
(a) Viết cấu hình electron của nguyên tử Sulfur (Z=16).
(b) Xác định vị trí của Sulfur trong bảng tuần hoàn và giải thích.
(1,0 điểm) Một nguyên tử của nguyên tố X có tổng số hạt proton, neutron, electron là 52 và có số khối là 35. Xác định kí hiệu nguyên tử nguyên tố X. Biết 16S, 17Cl, 18Ar
(0,5 điểm) Lấy một ít khí Neon trong tự nhiên và đo phổ được kết quả như hình bên dưới:
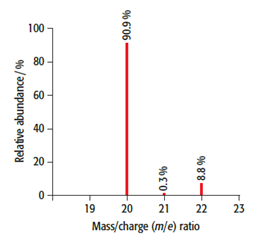
(a) Cho biết đồng vị nào của Neon phổ biến nhất trong tự nhiên.
(b) Tính nguyên tử khối trung bình của Neon.
(0,5 điểm) Cho các nguyên tố thuộc chu kì 3 (Z = 11 đến 17) gồm: Na, Mg, Al, Si, P, S, Cl. Em hãy giải thích qui luật biến đổi tính phi kim theo chiều tăng của điện tích hạt nhân.
Kí hiệu nguyên tử nào sau đây viết đúng?
.
.
.
.