Bộ 5 đề thi giữa kì Hóa 10 Cánh diều (2023-2024) có đáp án - Đề 5
31 câu hỏi
Các hạt cấu tạo nên hầu hết các nguyên tử là
proton và neutron.
electron, proton và neutron.
electron và neutron.
neutron và electron.
Nguyên tử fluorine có 9 proton, 9 electron và 10 neutron. Số khối của nguyên tử fluorine là
19.
28.
10.
9.
Trong nguyên tử Al, số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong Al là bao nhiêu?
13.
15.
27.
14.
Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
neutron và electron.
electron.
proton.
neutron.
Chu kì là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng
số lớp electron.
số electron hóa trị
số electron ở lớp ngoài cùng.
số electron.
Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về số
Neutron.
Proton.
Electron và Neutron.
Electron.
Nguyên tử sodium (Na) có số hiệu nguyên tử là 11 và có 12 neutron. Nguyên tử này có ký hiệu là
Trong các hiện tượng sau đây hiện tượng nào là hiện tượng vật lý?
Hòa tan đường vào nước, thu được dung dịch nước đường.
Nung đá vôi, thu được vôi sống và khí carbonic.
Đốt cháy khí methane, thu được khí carbonic và hơi nước.
Lưu huỳnh cháy trong không khí, tạo ra chất khí mùi hắc.
Nguyên tử chứa những hạt mang điện là
proton và neutron.
proton và electron.
electron và neutron.
proton và α.
Hiện tượng hoá học khác với hiện tượng vật lý là:
Biến đổi về hình dạng.
Khối lượng thay đổi.
Chỉ biến đổi về trạng thái.
Có sinh ra chất mới.
Cấu hình electron của nguyên tử Cl (Z = 17) là
1s22s22p63s23p4
1s22s22p63s23p5.
1s22s22p63s23p3.
1s22s22p63s23p6.
Các lớp electron được đánh số từ trong ra ngoài bằng các số nguyên dương: n=1,2,3,… với tên gọi là các chữ cái in hoa là:
K, L, M, O,…
L, M, N, O,…
K, L, M, N, …
K, M, N, O, …
Lớp M có số electron tối đa bằng
4.
18.
9.
3
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
, , .
, ,
, , .
, , .
Orbital s có dạng
hình cầu.
hình số 8 nổi.
hình tròn.
hình bầu dục.
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ tự là
s, p, f, d,…
d, p, s,…
s, d, p, f,…
s, p, d, f,…
Nitrogen có hai đồng vị bền là và . Oxygen có ba đồng vị bền là , và . Số hợp chất NO2 tạo bởi các đồng vị trên là
9
6
3
12
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
12.
11.
14.
13.
Nguyên tử của nguyên tố X có lớp ngoài cùng là lớp M, trên lớp M chứa 2 electron. Cấu hình electron của X và tính chất của X là
1s22s22p63s23p2, phi kim.
1s22s22p63s2, kim loại.
1s22s22p63s23p6, khí hiếm.
1s22s22p63s2, phi kim.
X được dùng để chế tạo đèn có cường độ sáng cao. Nguyên tử Xcó electron ở phân lớp 3d chỉ bằng một nửa electron ở phân lớp 4s. Số hiệu nguyên tử của X là
29.
24.
19.
21.
Thông tin nào sau đây không đúng về
Số khối là 206
Số đơn vị điện tích hạt nhân là 82.
Số neutron là 124
Số proton và neutron là 82
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M là
2.
1.
3.
0.
Nguyên tố X thuộc chu kì 4, nhóm IIIA. Cấu hình electron nguyên tử của X là:
1s22s22p63s23p63d104s24p1.
1s22s22p63s23p63d104s24p3.
1s22s22p63s23p63d34s2.
1s22s22p63s23p64s2.
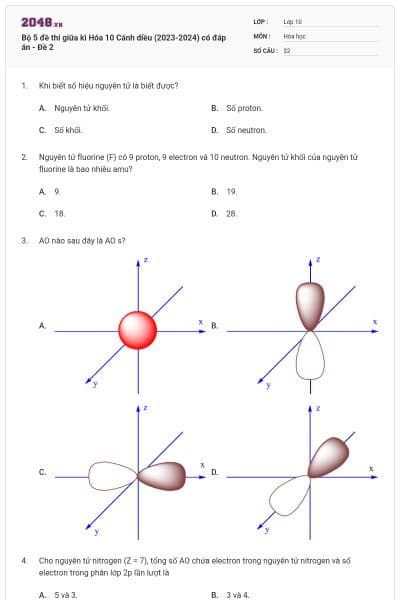
Cấu hình của nguyên tử sau biểu diễn bằng ô lượng tử. Thông tin nào không đúng khi nói về cấu hình đã cho?
Lớp ngoài cùng có 3 electron
Nguyên tử có 3 electron độc thân
Nguyên tử có 2 lớp electron
Nguyên tử có 7 electron
Nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Vị trí của X trong bảng hệ thống tuần hoàn là
X có số thứ tự 15, chu kì 3, nhóm VA.
X có số thứ tự 13, chu kì 3, nhóm IIIA.
X có số thứ tự 14, chu kì 3, nhóm IVA.
X có số thứ tự 12, chu kì 3, nhóm IIA.
Anion X- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của X trong bảng tuần hoàn:
Chu kì 3, nhóm II
Chu kì 3, nhóm VIIA
Chu kì 3, nhóm IVA
Chu kì 2, nhóm IVA
Tổng số hạt cơ bản của nguyên tử X là 13. Cấu hình electron của nguyên tử của X là
1s22s22p6.
1s22s1.
1s12s2.
1s22s2.
Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
Na+, F-, Ne.
Li+, F-, Ne.
K+, Cl-, Ar.
Na+, Cl-, Ar.
(1,0 điểm) Lithium có hai đồng vị bền là 6Li và 7Li. Phổ khối của nguyên tử Li được cho trong hình dưới.
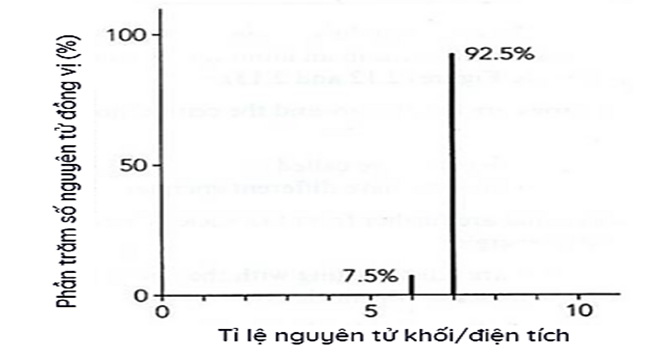
Tính nguyên tử khối trung bình của Lithium.
(1,5 điểm ) Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 58, trong đó số hạt mang điện hơn số hạt không mang điện là 18.
(a) Xác định Z, A và viết kí hiệu của X.
(b) Viết cấu hình electron của X và cho biết X có bao nhiêu electron độc thân.
(c) X là kim loại hay phi kim?
(0,5 điểm ) Một hợp chất có công thức XY2, trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Hợp chất này được sử dụng như chất trung gian để sản xuất sulfuric acid. Hãy viết cấu hình electron của X và Y.