Bộ 5 đề thi giữa kì Hóa 10 Cánh diều (2023-2024) có đáp án - Đề 1
31 câu hỏi
Hạt được tìm thấy ở lớp vỏ nguyên tử là
proton.
electron.
neutron.
hạt nhân.
Giá trị điện tích của electron (qe) là
+ 1,602.10-19C (coulomb).
– 9,11.10-19C (coulomb).
– 1,602.10-17C (coulomb).
– 1,602.10-19C (coulomb).
Khối lượng của một proton bằng khoảng bao nhiêu lần khối lượng của một electron? (biết khối lượng của proton là 1,673.10-24g, khối lượng của electron là 9,11.10-28 g)
lần.
1836 lần.
lần.
1 lần.
Đường kính của nguyên tử gấp đường kính của hạt nhân
100 lần.
10.000 lần.
100.000 lần.
1.000 lần.
Nguyên tố hóa học là tập hợp những nguyên tử
có cùng điện tích hạt nhân.
có cùng nguyên tử khối.
có cùng số khối.
có cùng số neutron trong hạt nhân.
Dựa vào số hiệu nguyên tử có thể biết được thông tin nào sau đây?
Số proton.
Số neutron.
Số khối.
Nguyên tử khối.
Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về
số neutron.
số electron.
số nucleon.
số đơn vị điện tích hạt nhân.
Điện tích hạt nhân của nguyên tử 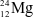 là
là
+ 12.
12.
24.
12+.
Có 3 nguyên tử: Những nguyên tử nào là đồng vị của một nguyên tố?
X, Y.
Y, Z.
X, Z.
X, Y, Z.
Sự chuyển động của electron theo mô hình nguyên tử của Rutherford- Bohr
chuyển động của electron trong nguyên tử theo một quỹ đạo xác định hình tròn hay bầu dục.
electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
electron chuyển động xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành đám mây electron.
các electron chuyển động có năng lượng bằng nhau.
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất khoảng
85%.
90%.
95%.
80%.
Hình nào sau đây biểu diễn orbital s?
A. 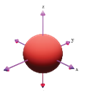 .
.
B. 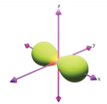 .
.
C. 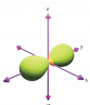 .
.
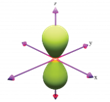 .
.
Số lượng orbital của lớp L là
3.
5.
4.
7.
Kí hiệu và số electron tối đa có trên lớp electron ứng với giá trị n = 3 tương ứng là
Lớp L và 18e.
Lớp L và 8e.
Lớp M và 18e.
Lớp M và 8e.
Các electron được điền theo thứ tự nào sau đây?
1s 2s 2p 3s 3p 3d 4s …
1s 2s 2p 3s 3p 4s 3d …
1s 2s 2p 3s 4s 3p 3d …
1s 2s 3s 4s 2p 3p 3d …
Cấu hình electron của nguyên tử Carbon (Z = 6) là
1s22s22p6.
1s22s22p2.
1s22s22p4.
2s22p4.
Cho các nguyên tử có cấu hình electron lớp ngoài cùng như sau: 3s2, 3s23p1, 3s23p4, 3s23p6. Số nguyên tử kim loại là
2.
1.
4.
3.
Trong bảng tuần hoàn các nguyên tố hóa học của Mendeleev năm 1869, các nguyên tố được sắp xếp thứ tự như thế nào?
Tăng dần theo khối lượng nguyên tử.
Giảm dần theo khối lượng nguyên tử.
Tăng dần theo số hiệu nguyên tử.
Giảm dần theo số hiệu nguyên tử.
Số thứ tự ô nguyên tố trong bảng tuần hoàn bằng
số hiệu nguyên tử.
số khối.
số neutron.
số electron hóa trị.
Trong bảng tuần hoàn các nguyên tố được xếp theo nguyên tắc nào?
theo chiều tăng của điện tích hạt nhân.
các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì.
các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
cả A, B, C.
Nguyên tố silicon thuộc ô thứ 14 trong bảng tuần hoàn, có số proton là
17.
16.
14.
15.
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X là 1s22s2;
Y là 1s22s22p5;
Z là 1s22s22p63s1;
T là 1s22s22p63s23p4;
Q là 1s22s22p63s2;
R là 1s22s22p63s23p6.
Các nguyên tố thuộc loại nguyên tố p là:
X, Y, Z.
R, Y, T.
Y, T, Q.
X, Q, Z.
Trong một chu kì của bảng tuần hoàn, khi điện tích hạt nhân tăng thì điều khẳng định nào sau đây không đúng?
Bán kính nguyên tử giảm.
Tính kim loại tăng.
Độ âm điện tăng.
Tính phi kim tăng.
Trong các hydroxide dưới đây, chất nào có tính base mạnh nhất?
2SiO3.
NaOH.
Mg(OH)2.
Al(OH)3.
Cho các nguyên tố 14Si, 15P, 16S, 17Cl và các hydroxide tương ứng: (a) H2SiO3; (b) H2SO4; (c) HClO4; (d) H3PO4. Thứ tự tính acid tăng dần của các chất là
(a), (c), (b), (d).
(d), (c), (b), (a).
(a), (b), (c), (d).
(a), (d), (b), (c).
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất tạo nên từ các nguyên tố đó
biến đổi liên tục theo chiều tăng của khối lượng nguyên tử.
biến đổi tuần hoàn theo chiều tăng của khối lượng nguyên tử.
biến đổi liên tục theo chiều tăng của điện tích hạt nhân.
biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
Biết nguyên tố X có số thứ tự là 8, thuộc chu kì 2, nhóm VIA của bảng tuần hoàn. Hãy xác định số hạt proton, số hạt electron của nguyên tử X?
8 proton, 8 electron.
7 proton, 8 electron.
7 proton, 7 electron.
8 proton, 7 electron.
(1,0 Điểm). Sắp xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử: K (Z=19), Na (Z=11), Mg (Z=12).
(1,0 Điểm). Nguyên tố sulfur ở ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn. Cho biết tính chất hóa học cơ bản của sulfur:
- Tính kim loại, tính phi kim.
- Công thức oxide cao nhất.
- Công thức hydroxide tương ứng.
- Tính acid, base của oxide cao nhất và hydroxide.
Thứ tự các mức năng lượng trong nguyên tử được xếp theo chiều tăng dần là
2p < 2s < 3p.
3p < 2p < 2s.
2s < 2p < 3s.
3p < 2s < 2p.
(1,0 Điểm). Một nguyên tố A có 3 đồng vị là A1, A2, A3. Tổng số khối của 3 đồng vị là 51, số khối của đồng vị A2 nhiều hơn số khối của đồng vị A1 là 1 đơn vị, số khối của đồng vị A3 bằng 9/8 số khối của đồng vị A1. Phương pháp phổ khối lượng xác nhận đồng vị A1 chiếm tỉ lệ phần trăm số nguyên tử là 99,577%. Biết rằng nguyên tử khối trung bình của A là 16,00507. Tính % số nguyên tử của đồng vị A2, đồng vị A3?