Bộ 5 đề thi giữa kì Hóa 10 Cánh diều (2023-2024) có đáp án - Đề 4
31 câu hỏi
Cấu hình electron của nguyên tử C (Z = 6) là
1s22s22p2.
2s22p4.
1s22s22p6.
1s22s22p4.
Chiều tăng dần bán kính ion của các ion sau: 11Na+, 12Mg2+; 13Al3+ là
Na+, Al3+, Mg2+.
Al3+, Na+, Mg2+.
Al3+, Mg2+, Na+.
Na+, Mg2+, Al3+.
Trong một nhóm của bảng tuần hoàn, khi điện tích hạt nhân tăng thì điều khẳng định nào sau đây đúng?
Bán kính nguyên tử giảm.
Tính kim loại tăng.
Độ âm điện tăng.
Tính phi kim tăng.
Orbital s có dạng
hình số 8 nổi.
hình cầu.
hình tròn.
hình bầu dục.
Cho mô hình cấu tạo nguyên tử của carbon như hình 1. Nguyên tố carbon thuộc nhóm nào trong bảng tuần hoàn?
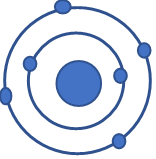
Hình 1. Mô hình cấu tạo nguyên tử carbon
IVA
IIA.
VA.
VIA.
Phát biểu nào sau đây không đúng?
Vỏ nguyên tử cấu thành từ các hạt electron.
Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
Hạt nhân nguyên tử cấu thành từ các hạt proton và neutron.
Để giúp em có phương pháp học tập và nghiên cứu môn Hóa học, có một số nhận định sau:
(1) Cần nắm vững nội dung chính của các vấn đề lý thuyết hóa học.
(2) Chủ động tìm hiểu thế giới tự nhiên thông qua hoạt động khám phá.
(3) Chủ động liên hệ, gắn kết những nội dung kiến thức và kinh nghiệm để giải thích các hiện tượng tự nhiên, vận dụng vào thực tiễn.
Số nhận định đúng là
2.
0.
3.
1.
Anion Y- có cấu hình electron giống neon (Z = 10). Y thuộc chu kì
3.
1.
4.
2.
Khối lượng của nguyên tử magnesium là 39,8271.10-27 kg. Khối lượng của magnesium theo amu là
23,985.10-3.
24,000.
23,985.
66,133.10-51.
Nguyên tử nguyên tố oxygen có cấu hình electron 1s22s22p4. Nhận định đúng:
Nguyên tử có 7 electron.
Nguyên tử có 6 electron lớp ngoài cùng.
Nguyên tử lớp thứ 2 có 4 electron.
Nguyên tử có 7 lớp electron.
Các đồng vị của cùng một nguyên tố hoá học thì chúng có
cùng số hạt neutron.
cùng số neutron nhưng khác số khối.
cùng số hạt proton nhưng khác số neutron.
cùng số khối.
Ngành nào sau đây không liên quan đến hóa học?
Thuốc chữa bệnh
Vũ trụ.
Môi trường
Vật liệu
Orbital nguyên tử là
khu vực không gian xung quanh hạt nhân mà tại đó xác suất tìm thấy electron là lớn nhất (90%)
quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
đám mây chứa electron có dạng hình số 8 nổi.
đám mây chứa electron có dạng hình cầu.
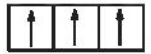
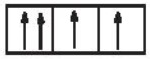
Sự phân bố electron theo ô orbital nào dưới đây là đúng?

Nguyên tố có tính phi kim mạnh nhất là?
N.
F.
Cl.
O.
Cho các nguyên tử sau: . Các nguyên tử nào thuộc cùng một nguyên tố hóa học?
B và E, C và F.
A và D, B và E.
A và C, B và
A và B, C và D.
Hiện nay bảng tuần hoàn các nguyên tố hoá học được sắp xếp theo chiều tăng dần
Bán kính nguyên tử
Khối lượng nguyên tử.
Số khối.
Số hiệu nguyên tử.
Một nguyên tử X có 16 proton, 16 electron và 16 neutron. Nguyên tử X có kí hiệu là
.
.
.
.
Carbon là nguyên tố phổ biến thứ 4 trong vũ trụ về khối lượng sau hydrogen, helium, và oxygen. Carbon tồn tại đa số trong mọi sự sống hữu cơ và nó là nền tảng của hóa hữu cơ. Trong số 15 đồng vị của C, đồng vị 12C và 13C là các đồng vị bền, còn đồng vị phóng xạ 14C phát sinh do sự tương tác của neutron (1n) trong bức xạ vũ trụ với nitrogen (14N) trong khí quyển, nên trong khí quyển luôn có một lượng 14C không đổi dưới dạng 14CO2. Qua quá trình quang hợp của thực vật tiếp nhận carbon từ CO2 trong không khí tạo ra chất hữu cơ, và từ đó làm thức ăn cho các sinh vật khác. Nó dẫn đến tỷ lệ đồng vị carbon trong các mô hữu cơ của một cơ thể đang sống giống như trong CO2 của khí quyển. Khi sinh vật chết thì sự trao đổi carbon ngừng lại. Phản ứng phân rã 14C làm tỷ lệ đồng vị 14C trong tổng lượng carbon của mẫu vật giảm dần theo thời gian. Xác định được tỷ số đồng vị 14C trong tổng lượng carbon, với một số hiệu chỉnh, sẽ xác định được niên đại của mẫu vật.
Thành phần nguyên tử là
6 proton, 6 neutron, 6 electron
6 proton, 8 neutron, 6 electron
8 proton, 6 neutron, 6 electron
6 proton, 6 neutron, 8 electron
Carbon là nguyên tố phổ biến thứ 4 trong vũ trụ về khối lượng sau hydrogen, helium, và oxygen. Carbon tồn tại đa số trong mọi sự sống hữu cơ và nó là nền tảng của hóa hữu cơ. Trong số 15 đồng vị của C, đồng vị 12C và 13C là các đồng vị bền, còn đồng vị phóng xạ 14C phát sinh do sự tương tác của neutron (1n) trong bức xạ vũ trụ với nitrogen (14N) trong khí quyển, nên trong khí quyển luôn có một lượng 14C không đổi dưới dạng 14CO2. Qua quá trình quang hợp của thực vật tiếp nhận carbon từ CO2 trong không khí tạo ra chất hữu cơ, và từ đó làm thức ăn cho các sinh vật khác. Nó dẫn đến tỷ lệ đồng vị carbon trong các mô hữu cơ của một cơ thể đang sống giống như trong CO2 của khí quyển. Khi sinh vật chết thì sự trao đổi carbon ngừng lại. Phản ứng phân rã 14C làm tỷ lệ đồng vị 14C trong tổng lượng carbon của mẫu vật giảm dần theo thời gian. Xác định được tỷ số đồng vị 14C trong tổng lượng carbon, với một số hiệu chỉnh, sẽ xác định được niên đại của mẫu vật.
Phát biểu nào sau đây đúng?
12C, 13C và 14C là những nguyên tố khác nhau của nguyên tử carbon.
12C và 13C là có cùng số neutron trong hạt nhân.
12C là đồng vị phóng xạ.
14C ứng dụng để xác định niên đại của mẫu vật.
Công thức hóa học ứng với oxide cao nhất của nguyên tố R là R2O3. Trong bảng tuần hoàn, nguyên tố R thuộc nhóm
IIA.
IA
IVA.
IIIA.
Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
proton.
neutron và electron.
electron.
neutron.
Khối lượng của nguyên tử chủ yếu là
Khối lượng của hạt nhân.
Khối lượng của hạt neutron.
Khối lượng của lớp vỏ.
Khối lượng của hạt proton.
Mỗi orbital nguyên tử chứa tối đa
4 electron.
1 electron.
3 electron.
2 electron.
Nguyên tắc nào để sắp xếp các nguyên tố trong bảng tuần hoàn sau đây là sai?
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
Có sự định hướng không gian.
Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Khác nhau về mức năng lượng.
Có cùng mức năng lượng.
Trong nguyên tử, lớp thứ 3 (M) chứa tối đa:
6 electron.
18 electron.
8 electron.
10electron.
Đối tượng nào sau đây là đối tượng nghiên cứu của hóa học?
Chất và sự biến đổi về chất.
Sự hình thành hệ mặt trời
Sự vận chuyển của máu trong hệ tuần hoàn
Sự sinh trưởng và phát triển của thực vật.
(1đ) Phổ khối của neon được biểu diễn như ở hình dưới.
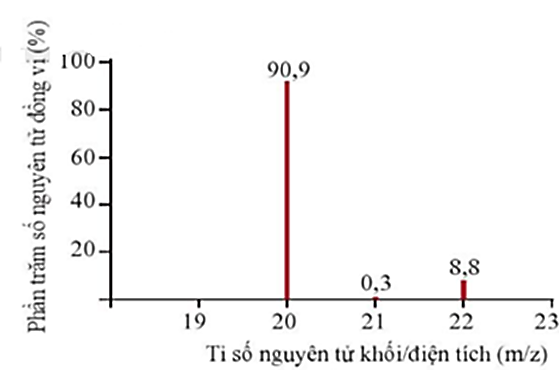
Dựa vào phổ khối của neon hãy cho biết:
(a) Neon có bao nhiêu đồng vị bền?
(b) Tính nguyên tử khối trung bình của neon.
(1đ) Viết cấu hình electron và dự đoán tính chất hóa học (tính kim loại, tính phi kim, tính trơ):
(a) Nguyên tử của nguyên tố X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 7
(b) Nguyên tử của nguyên tố Y có phân mức năng lượng cao nhất là 3p1
(1đ) Ion X3+ và ion Y2- đều có cấu hình e lớp ngoài cùng là 2p6. Hãy xác định vị trí của X, Y trong bảng tuần hoàn?