Bộ 3 đề thi giữa kì 1 Hóa 10 Cánh diều cấu trúc mới có đáp án - Đề 3
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Hạt nhân của hầu hết các nguyên tử gồm các loại hạt là
electron và proton.
proton và neutron.
electron và neutron.
electron, proton và neutron.
Nhận định nào sai khi nói về neutron?
Có khối lượng lớn hơn khối lượng electron.
Không mang điện.
Tồn tại trong hạt nhân nguyên tử.
Có khối lượng bằng khối lượng proton.
Trong nguyên tử, hạt mang điện tích dương là
neutron và proton.
proton.
electron.
neutron.
Nguyên tử có đường kính nhỏ nhất là
Helium.
Neon.
Potassium.
Calcium.
Trong tự nhiên, lithium có hai đồng vị là 6Li và 7Li với tỉ lệ phần trăm số nguyên tử của mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là
6,07.
6,50.
6,90.
6,93.
Số hiệu nguyên tử của nguyên tố hoá học bằng
số proton của nguyên tử.
số thứ tự của chu kì.
số thứ tự của nhóm.
số electron lớp ngoài cùng của nguyên tử.
Số neutron (N) trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối A, số hiệu nguyên tử (Z) theo công thức:
A = Z – N.
N = A – Z.
A = N – Z.
Z = N + A.
Nguyên tử calcium có điện tích hạt nhân là +20. Số hạt mang điện có trong nguyên tử calcium là
20.
40.
60.
30.
Số proton và số neutron có trong một nguyên tử aluminium (\[{}_{13}^{27}Al\]) lần lượt là
12 và 14.
13 và 13.
13 và 15.
13 và 14.
Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
Khác nhau về mức năng lượng.
Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Có cùng sự định hướng không gian.
Có cùng mức năng lượng.
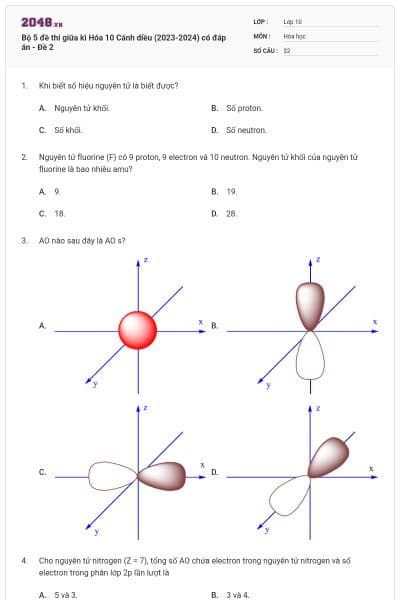
Orbital s có dạng
hình bầu dục.
hình cầu.
hình tròn.
hình số tám nổi.
Cấu hình electron của nguyên tử P (Z = 15) là
1s22s22p63s23p3.
1s22s22p63s23p5.
1s22s22p63s23p13d2.
1s22s22p63s23p23d1.
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
chu kì.
ô nguyên tố.
nhóm.
orbital.
Bảng tuần hoàn các nguyên tố hóa học hiện tại có bao nhiêu chu kì?
4.
5.
6.
7.
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p2. X thuộc
chu kì 3.
chu kì 2.
chu kì 4.
chu kì 5.
Nguyên tố Y ở chu kì 3, nhóm VA của bảng tuần hoàn. Cấu hình electron nguyên tử của Y là
1s22s22p63s23p5.
1s22s22p63s23p3.
1s22s22p63s23p63d54s2.
1s22s22p63s23p63d34s2.
Nguyên tố nào sau đây thuộc nhóm A trong bảng tuần hoàn?
[Ne]3s23p3.
[Ar]3d14s2.
[Ar]3d74s2.
[Ar]3d54s2.
Nguyên tử của nguyên tố A và B có phân mức năng lượng cao nhất lần lượt là 3d6 và 3p2. Trong bảng hệ thống tuần hoàn, vị trí của A và B lần lượt là
chu kì 4, nhóm VIA và chu kì 3, nhóm IVA.
chu kì 4, nhóm VIB và chu kì 3, nhóm IIIA.
chu kì 3, nhóm VIB và chu kì 3, nhóm IVA.
chu kì 4, nhóm VIIIB và chu kì 3, nhóm IVA.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Nguyên tử nguyên tố X có cấu hình electron là 1s22s22p63s23p3.
a. X là một phi kim.
b. X ở ô số 15 trong bảng tuần hoàn.
c. Nguyên tử của nguyên tố X có 9 electron p.
d. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Bảng tuần hoàn các nguyên tố hóa học hiện nay gồm 118 nguyên tố.
a. Số thứ tự của nhóm luôn luôn bằng số electron ở lớp vỏ ngoài cùng của nguyên tử nguyên tố thuộc nhóm đó.
b. Số electron ở lớp vỏ ngoài cùng càng lớn thì số thứ tự của nhóm càng lớn.
c. Nguyên tử các nguyên tố trong cùng một hàng có cùng số lớp electron.
d. Nguyên tử các nguyên tố trong cùng một cột có cùng số electron hóa trị.
Một cation M+ và một anion X- có cùng cấu hình electron là \(1\;{{\rm{s}}^2}2\;{{\rm{s}}^2}2{{\rm{p}}^6}\)
a. M và X là hai đồng vị của cùng một nguyên tố.
b. M là một kim loại và X là một phi kim.
c. M là một phi kim và X là một kim loại.
d. Số lượng proton của M và X hơn kém nhau 1 đơn vị.
Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện.
a. Nguyên tử có kích thước rất nhỏ nên dùng đơn vị đo kích thước như nm, pm, \[\mathop A\limits^o \].
b. Đường kính nguyên tử lớn hơn đường kính hạt nhân khoảng 1010 lần.
c. Đơn vị khối lượng nguyên tử là amu.
d. Khối lượng của nguyên tử tập trung chủ yếu ở lớp vỏ.
Phần III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và số lượng electron có trong phân tử NH3 là?
Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình electron ngoài cùng là 3d74s2. Cobalt ở ô thứ bao nhiêu trong bảng tuần hoàn?
Nguyên tử của nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Viết cấu hình electron có thể có của X.
Nguyên tố chlorine (Cl) có Z = 17, có trong thành phần của muối ăn. Hãy xác định vị trí (ô, chu kì, nhóm) của nguyên tố Cl trong bảng tuần hoàn.
Trong tự nhiên nguyên tố copper (kí hiệu: Cu) có 2 đồng vị là \[{}_{29}^{63}Cu\]và \[{}_{29}^{65}Cu\], trong đó đồng vị \[{}_{29}^{65}Cu\]chiếm 27% về số nguyên tử. Phần trăm khối lượng của \[{}_{29}^{65}Cu\]trong phân tử Cu2O (biết rằng nguyên tử khối của O bằng 16) là?
Cho nguyên tử bền X có số electron ở phân lớp s là 7, số hạt không mang điện là nghiệm của phương trình x2 – 30x = 0. Vị trí ô của X trong bảng tuần hoàn là?