Bộ 3 đề thi giữa kì 1 Hóa 10 Cánh diều cấu trúc mới có đáp án - Đề 1
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Vỏ của nguyên tử đều tạo bởi hạt nào sau đây?
Neutron.
Electron.
Neutron và proton.
Proton.
Trong nguyên tử, hạt mang điện tích dương là
electron.
proton và electron.
neutron.
proton.
Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
proton.
neutron.
electron.
neutron và electron.
Nguyên tử trung hoà về điện vì
được cấu tạo nên bởi các hạt không mang điện.
có tổng số hạt electron bằng tổng số hạt neutron.
có tổng số hạt electron bằng tổng số hạt proton.
có tổng số hạt proton bằng tổng số hạt neutron.
Số hiệu nguyên tử cho biết thông tin nào sau đây?
Số khối.
Số electron.
Số neutron.
Nguyên tử khối.
Nguyên tố hóa học là tập hợp những nguyên tử có cùng
số khối.
số hạt neutron.
số hạt proton.
số hạt neutron và số hạt proton.
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
cùng số proton nhưng khác nhau về số neutron.
cùng số neutron nhưng khác nhau về số proton.
cùng tổng số proton và neutron nhưng khác nhau về số electron.
cùng số electron nhưng khác nhau về tổng số proton và neutron.
Nguyên tử fluorine có 9 electron, 10 neutron, kí hiệu nguyên tử của nguyên tố fluorine là
\({}_{19}^9Fe.\)
\({}_9^{19}F.\)
\({}_9^{19}Fe.\)
\({}_{19}^9F.\)
Cho các phát biểu sau:
(1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số hiệu nguyên tử.
(2) Tổng số proton và số neutron trong một hạt nhân nguyên tử được gọi là số khối.
(3) Tất cả các nguyên tử nguyên tố khí hiếm đều có số electron ở lớp ngoài cùng bằng 8.
(4) Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số neutron.
Số phát biểu không đúng là
1.
2.
3.
4.
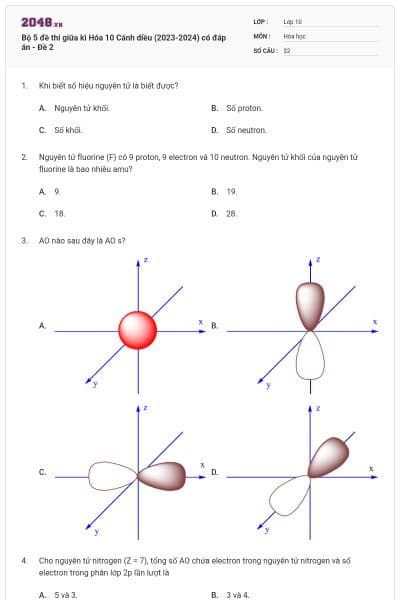
Orbital nguyên tử là
đám mây chứa electron có dạng hình cầu.
đám mây chứa electron có dạng hình số tám nổi.
khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron trong khu vực đó là lớn nhất.
quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Lớp M có số phân lớp electron là
1.
2.
3
4.
Nguyên tử fluorine (Z = 9) có cấu hình electron là
1s22s22p3.
1s22s32p4.
1s22s22p5.
1s22s12p6.
Cấu hình electron của nguyên tử nguyên tố X có dạng 1s22s22p63s23p5. Phát biểu nào sau đây là sai?
X có 17 electron trong nguyên tử.
X là một phi kim.
Trong bảng tuần hoàn, X thuộc nhóm VA.
X thuộc chu kì 3 trong bảng tuần hoàn.
Số thứ tự của ô nguyên tố bằng
số hiệu nguyên tử của nguyên tố đó.
số lớp electron của nguyên tử nguyên tố đó.
số electron lớp ngoài cùng của nguyên tử nguyên tố đó.
tổng số electron lớp ngoài cùng và phân lớp sát lớp ngoài cùng của nguyên tử nguyên tố đó.
Chu kì 3 của bảng hệ thống tuần hoàn có số nguyên tố là
2 nguyên tố.B. 8 nguyên tố.C. 10 nguyên tố.D. 18 nguyên tố.
8 nguyên tố.
10 nguyên tố.
18 nguyên tố.
Mendeleev sắp xếp các nguyên tố hoá học trong bảng tuần hoàn dựa theo quy luật về
số hiệu nguyên tử.
khối lượng nguyên tử.
cấu hình electron.
số khối.
Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 5 electron. Trong bảng tuần hoàn, X thuộc ô
6.
8.
15.
16.
Nguyên tố X có số hiệu nguyên tử là 16. X thuộc:
chu kì 4.
nhóm VIA.
chu kì 7.
nhóm IIIA.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Cấu hình electron của nguyên tố aluminium (nhôm) là 1s22s22p63s23p1.
a. Nguyên tử của nguyên tố nhôm có 13 proton.
b. Số hiệu nguyên tử của nguyên tố nhôm là 26.
c. Số electron lớp ngoài cùng của nhôm là 1.
d. Nhôm là nguyên tố khối p.
Cho nguyên tử của nguyên tố Mg có 12 proton và 12 neutron.
a. Điện tích hạt nhân nguyên tử Mg là +12.
b. Số hạt electron trong nguyên tử Mg là 24 hạt.
c. Số khối của nguyên tử Mg là 24.
d. Kí hiệu của nguyên tử Mg trên là \[{}_{24}^{12}Mg.\]
Nguyên tử của nguyên tố A có tổng số electron ở phân lớp s là 6 và nguyên tố thuộc nguyên tố s. Trong bảng hệ thống tuần hoàn:
a.A thuộc ô thứ 16.
b.A thuộc nhóm VIIA.
c.A thuộc chu kì 3.
d. A là nguyên tố Mg.
Nguyên tử nitrogen có 7 proton, 8 neutron. (Biết mp ≈ mn ≈ 1u; me ≈ 0,00055u).
a. Nitrogen có 8 electron ở lớp vỏ nguyên tử.
b. Khối lượng nguyên tử nitrogen tập trung chủ yếu ở hạt nhân.
c. Khối lượng tương đối của nguyên tử nitrogen này là 15 amu.
d. Nitrogen là khí hiếm.
Phần III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Khối lượng của nguyên tử calcium là 66,5495.10–27kg. Khối lượng của nguyên tử calcium theo amu là?
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p3. Số electron độc thân của M là?
Số electron tối đa trong mỗi lớp (≤ 4) được tính theo công thức là?
Cho cấu hình electron nguyên tử của các nguyên tố sau:
(X) 1s22s22p63s2; (Y) 1s22s22p63s23p64s1;
(Z) 1s22s22p63s23p3; (T) 1s22s22p63s23p63d84s2.
Các nguyên tố thuộc nhóm A trong bảng tuần hoàn là?
Nguyên tử của nguyên tố R có tổng số hạt proton, neutron và electron là 116, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 24. Trong bảng tuần hoàn, R thuộc ô số?
Biết X ở chu kì 3 và Y ở chu kì 2 trong bảng tuần hoàn các nguyên tố hóa học. Tổng số electron lớp ngoài cùng của X và Y là 10. Ở trạng thái cơ bản số electron p của X nhiều hơn số electron p của Y là 8. X, Y thuộc nhóm nào trong bảng tuần hoàn?