60 bài tập Nhóm halogen có đáp án
60 câu hỏi
Chủ đề 7.1. Nguyên tố và đơn chất halogen
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Nguyên tố nào sau đây là nguyên tố halogen?
Nitrogen.
Bromine
Oxygen.
Carbon.
Ở điều kiện thường, đơn chất halogen nào sau đây tồn tại ở thể khí màu lục nhạt?
![]()
![]()
![]()
![]()
Cấu hình electron lớp ngoài cùng của các nguyên tử halogen có dạng
![]()
![]()
![]()
![]()
Khi đun nóng, chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là
![]()
![]()
![]()
![]()
Đơn chất halogen nào sau đây là chất rắn ở điều kiện thường?
Iodine.
Bromine.
Chlorine.
Fluorine.
Liên kết trong đơn chất halogen là liên kết
cộng hóa trị khôngphân cực.
hydrogen.
ion.
cộng hóa trị phân cực.
Hòa tan khí ![]() vào dung dịch KOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất
vào dung dịch KOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất
![]()
![]()
![]()
![]()
Trường hợp nào sau đây không xảy ra phản ứng?
![]()
![]()
![]()
![]()
Cho phản ứng tổng quát sau: ![]()
X có thể là chất nào sau đây?
![]()
![]()
![]()
![]()
Dẫn 2 luồng khí chlorine đi qua 2 ống nghiệm đựng dung dịch KOH. Ống nghiệm thứ nhất đựng dung dịch KOH loãng và nguội, ống nghiệm thứ 2 đựng dung dịch KOH đậm đặc và đun nóng ở ![]() Sau khi phản ứng xảy ra hoàn toàn, nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỉ lệ thể tích khí Cl2 qua dung dịch thứ nhất và dung dịch thứ 2 tương ứng là
Sau khi phản ứng xảy ra hoàn toàn, nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỉ lệ thể tích khí Cl2 qua dung dịch thứ nhất và dung dịch thứ 2 tương ứng là
1: 3.
5: 3.
4: 4.
2: 4.
Quá trình sản xuất khí chlorine trong công nghiệp hiện nay dựa trên phản ứng là
![]()
![]()
![]()
![]()
Phát biểu nào sau đây không đúng về tính chất vật lý của đơn chất halogen?
Fluorine là chất khí màu lục nhạt.
Chlorine là chất khí màu vàng lục.
Iodine dễ bị thăng hoa.
Bromine là chất lỏng không màu.
Bromine có lẫn một ít tạp chất là chlorine. Một trong các hoá chất có thể loại bỏ chlorine ra khỏi hỗn hợp là
NaOH.
KCl.
![]()
KBr.
Điều chế chlorine trong phòng thí nghiệm qua phương trình:
![]()
Với a, b, c, d, e là các số nguyên tối giản, giá trị a + b là
4.
9
5.
8.
Javel là chất oxi hóa mạnh nên nó có khả năng phân hủy phân tử hữu cơ hiệu quả, tất cả các loại vi trùng nguy hại và chất có mùi khó ngửi như urea, ammonia. Chính vì vậy, Javel thường được dùng trong việc tẩy quần áo, vệ sinh nhà cửa ... Trong công nghiệp, nước Javel được sản xuất bằng cách điện phân dung dịch sodium chloride bão hòa trong thùng điện phân không có màng ngăn. Giai đoạn ![]() tác dụng với dung dịch NaOH tạo nước Javel theo phương trình sau:
tác dụng với dung dịch NaOH tạo nước Javel theo phương trình sau:
![]()
a. NaClO là chất giúp nước Javel có tính oxi hóa.
b. Số oxi hóa của Cl trong NaClO là +2
c. Ứng dụng của nước Javel dùng để tẩy trùng, tẩy trắng...
d. Trong phản ứng trên ![]() vừa là chất oxi hóa, vừa là chất khử.
vừa là chất oxi hóa, vừa là chất khử.
Số phát biểu đúng là
4.
3.
1.
2.
Trong các hình vẽ mô tả cách thu khí chlorine sau đây, hình vẽ nào mô tả đúng cách thu khí chlorine trong phòng thí nghiệm?
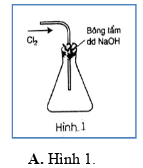
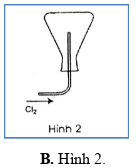
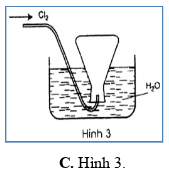
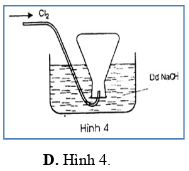
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Các nguyên tố phổ biến thuộc nhóm halogen (VIIA) trong bảng tuần hoàn các nguyên tố hóa học gồm: F (Z = 9), Cl (Z = 17), Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tạo dạng phân tử ![]() giữa các phân tử
giữa các phân tử ![]() thường có tương tác với nhau. Cho giá trị năng lượng liên kết
thường có tương tác với nhau. Cho giá trị năng lượng liên kết ![]() ở bảng sau:
ở bảng sau:
| F - F | Cl - Cl | Br - Br | I - I |
Năng lượng liên kết ( ở | 159 | 243 | 193 | 151 |
Năng lượng liên kết X – X càng lớn thì liên kết càng bền.
a. Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ![]()
b. Liên kết giữa các nguyên tử trong ![]() là liên kết cộng hóa trị không phân cực.
là liên kết cộng hóa trị không phân cực.
c. Tương tác giữa các phân tử ![]() là tương tác van der Waals.
là tương tác van der Waals.
d. Năng lượng liên kết Cl – Cl lớn nhất trong dãy trên vì Cl có bán kính nguyên tử nhỏ nhất.
Nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học còn gọi là nhóm halogen. Trong nhóm halogen thì
a. số oxi hóa đặc trưng của các halogen trong hợp chất là -1.
b. các halogen tồn tại ở dạng đơn chất trong tự nhiên.
c. các halogen không độc, không màu, không tan trong nước.
d. nguyên tố đầu tiên trong nhóm halogen là chất khí ở nhiệt độ phòng.
Cho các nhận định về các nguyên tố halogen như sau:
a. Màu các đơn chất đậm dần theo thứ tự 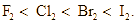
b. Nếu chẳng may làm đổ bromine lỏng xuống bàn làm thí nghiệm, có thể dùng nước vôi để loại bỏ hoàn toàn lượng bromine này.
c. Trong phản ứng với hydrogen, khả năng phản ứng của halogen tăng dần từ ![]() đến
đến ![]()
d. Liên kết trong phân tử halogen là liên kết cộng hóa trị không phân cực.
Phản ứng giữa chlorine và hydrogen cần điều kiện ánh sáng hoặc nhiệt độ xảy theo phương trình:
![]()
a. Chlorine là chất khí có màu nâu đỏ.
b. Chlorine đóng vai trò là chất oxi hóa.
c. Dung dịch HCl khi tác dụng với ![]() sản phẩm xuất hiện kết tủa màu trắng.
sản phẩm xuất hiện kết tủa màu trắng.
d. Liên kết giữa H với Cl trong HCl là liên kết cộng hóa trị phân cực.
Khi tan vào nước, một phần ![]() tác dụng với nước tạo thành HCl và HClO. HClO có tính oxi hóa mạnh nên nước chlorine có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt.
tác dụng với nước tạo thành HCl và HClO. HClO có tính oxi hóa mạnh nên nước chlorine có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt.
a. Trong phản ứng của ![]() với
với ![]() đóng vai trò là chất oxi hóa,
đóng vai trò là chất oxi hóa, ![]() đóng vai trò là chất khử.
đóng vai trò là chất khử.
b. Số oxi hóa của chlorine trong các chất ![]() HCl, HClO lần lượt là 0, +1, +3.
HCl, HClO lần lượt là 0, +1, +3.
c. Phản ứng giữa ![]() và
và ![]() là phản ứng thuận nghịch.
là phản ứng thuận nghịch.
d. Acid HClO có tính acid mạnh hơn HCl.
Xét tính chất của các halogen. Cho các phát biểu sau:
a. Màu sắc các halogen đậm dần từ fluorine đến iodine.
b. Đặc điểm chung của các đơn chất halogen là tác dụng mạnh với nước.
c. Các đơn chất halogen đều là chất khí ở nhiệt độ thường.
d. Nhiệt độ nóng chảy và nhiệt độ sôi các halogen tăng dần từ fluorine đến iodine.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Số electron lớp ngoài cùng của các nguyên tố nhóm halogen là?
Halogen X được sử dụng trong sản xuất chất dẻo ma sát thấp dùng cho thiết bị nhà bếp, dụng cụ thí nghiệm,... Một số hợp chất khác của X dùng trong sản xuất nhôm; sản xuất thuốc trừ sâu, chống gián; một số muối X khác được thêm vào thuốc đánh răng, tạo men răng,...
Chất X là?
Một bạn học sinh thực hiện thí nghiệm như hình vẽ và đưa ra kết luận sau:
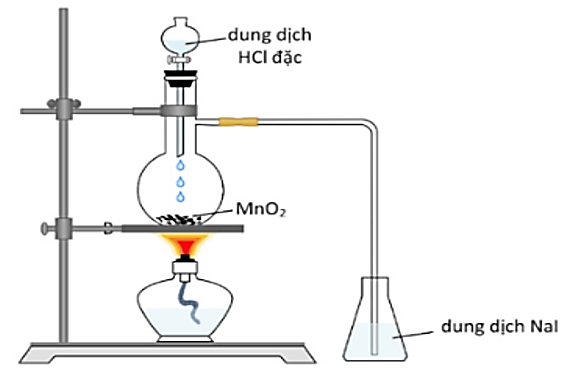
Điều chế khí chlorine trong phòng thí nghiệm
(1) Nếu thêm vài giọt hồ tinh bột vào dung dịch NaI thì dung dịch đậm màu dần và chuyển sang màu xanh tím.
(2) Có thể thay dung dịch HCl đặc bằng dung dịch ![]() đặc.
đặc.
(3) Thí nghiệm trên chứng tỏ tính oxi hóa của iodine mạnh hơn chlorine.
(4) Để thu được khí chlorine tinh khiết có thể đưa khí chlorine lần lượt qua bình 1 đựng dung dịch NaCl bão hòa và bình 2 đựng ![]() đặc.
đặc.
(5) Thay dung dịch NaI bằng dung dịch bằng dung dịch NaBr thì hiện tượng xảy ra tương tự.
Có bao nhiêu phát biểu đúng?
Cho các phương trình phản ứng sau:
a) ![]()
b) ![]()
c) ![]()
d) ![]()
e) ![]()
Số phản ứng trong đó Cl2 chỉ đóng vai trò chất oxi hóa là bao nhiêu?
Thực hiện các thí nghiệm sau:
(a) ![]() ®
®
(b) Dung dịch![]()
(c) Dung dịch ![]() ®
®
(d) Dung dịch ![]() ®
®
Ở điều kiện thích hợp, có bao nhiêu phản ứng tạo ra đơn chất?
Cho các phát biểu sau về halogen.
(a) Đơn chất chlorine có tính oxi hoá mạnh hơn đơn chất bromine và iodine.
(b) Tương tác van der Waals của các đơn chất halogen tăng từ fluorine đến iodine đã góp phần làm tăng nhiệt độ sôi của chúng.
(c) Thành phần của nước bromine gồm các chất: Br2, H2O, HBr, HBrO.
(d) Hóa trị phổ biến của nguyên tố halogen là I.
(e) Đơn chất iodine phản ứng được với nước và với dung dịch sodium bromide.
Số phát biểu sai là?
Cho dãy các chất sau: dung dịch NaOH, KF, NaBr, H2O, Ca, Fe, Cu. Khí chlorine tác dụng trực tiếp với bao nhiêu chất trong dãy trên?
Cho hình vẽ mô tả thí nghiệm điều chế chlorine từ MnO2 và dung dịch HCl:
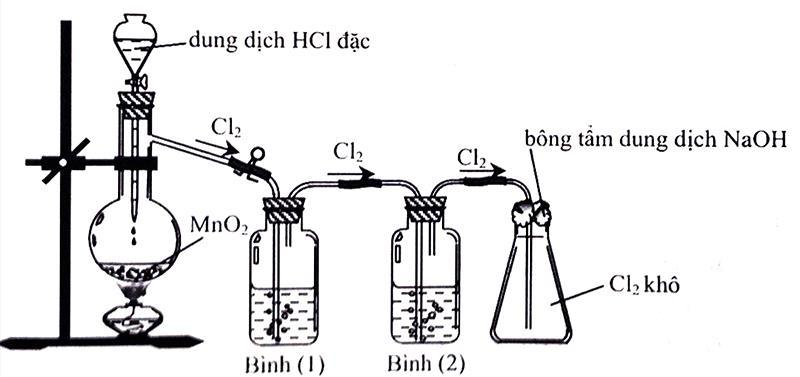
a. Để thu được khí chlorine khô thì bình (1) và bình (2) lần lượt đựng dung dịch NaCl bão hòa và dung dịch H2SO4 đặc.
b. Bông tẩm dung dịch NaOH dùng để ngăn không cho khí chlorine thoát ra ngoài.
c. Có thể thay acid HCl đặc bằng acid H2SO4 đặc.
d. Có thể thu khí chlorine bằng phương pháp đẩy nước.
Số phát biểu đúng là?
Chủ đề 7.2. Hydrogen halide và hydrohalic acid
II. TRẮC NGHIỆM
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Để khắc chữ lên thủy tinh người ta dùng chất nào?
HF đặc.
HBr đặc.
HI đặc.
HCl đặc.
Dung dịch dùng để nhận biết các ion halide là
![]()
Quỳ tím.
NaOH.
HCl.
Nước Javel là hỗn hợp của các chất tan nào sau đây?
NaCl, NaClO.
![]()
HCl, HClO.
![]()
Dựa vào độ âm điện, liên kết nào sau đây có độ phân cực lớn nhất?
H – F.
H – Cl.
H – Br.
H – I.
Phản ứng được dùng để điều chế khí hydrogen chloride trong phòng thí nghiệm là
H2 + Cl2![]() 2HCl
2HCl
Cl2 + H2O ![]() HCl + HClO
HCl + HClO
Cl2 + SO2 + 2H2O ® 2HCl + H2SO4
NaClrắn + H2SO4 đặc![]() NaHSO4 + HCl
NaHSO4 + HCl
Ở áp suất thường, hydrogen halide (HX) nào sau đây có nhiệt độ sôi cao nhất?
HF.
HCl.
HBr.
HI.
Phát biểu nào sau đây liên quan đến halogen halide (HX) là không đúng?
Các halogen halide dễ tan trong nước phân li hoàn toàn thanh ![]() và
và ![]()
Liên kết H – I kém bền nhất trong các liên kết H – X.
Tính acid của các hydrogen halide tăng dần từ HF đến HI.
Liên kết trong phân tử hydrogen halide là liên kết công hóa trị không phân cực.
Trong dãy hydrogen halide, từ HCl đến HI, nhiệt độ sôi tăng dần chủ yếu do
tương tác vander Waals tăng dần.
phân tử khối tăng dần.
độ bền liên kết giảm dần.
độ phân cực liên kết giảm dần.
Cho muối halide nào sau đây tác dụng với dung dịch ![]() đặc, nóng thì chỉ xảy ra phản ứng trao đổi?
đặc, nóng thì chỉ xảy ra phản ứng trao đổi?
KBr.
KI.
NaCl.
NaBr.
Ion halide được sắp xếp theo chiều giảm dần tính khử:
![]()
![]()
![]()
![]()
Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với các hydrogen halide còn lại là do
fluorine có nguyên tử khối nhỏ nhất.
năng lượng liên kết H – F bền vững làm cho HF khó bay hơi.
các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
fluorine là phi kim mạnh nhất.
Cho phản ứng hóa học: 3Cl2 + 6KOH![]() 5KCl + KClO3 + H2O
5KCl + KClO3 + H2O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
3: 1.
1: 3.
5: 1.
1: 5.
Có hai ống nghiệm, mỗi ống chứa 2 mL dung dịch muối của sodium. Cho vài giọt dung dịch ![]() vào ống thứ nhất, thu được kết tủa. Nhỏ vài giọt nước
vào ống thứ nhất, thu được kết tủa. Nhỏ vài giọt nước ![]() vào ống thứ hai, lắc nhẹ, thêm 1 mL benzene và lắc đều, lớp benzene từ không màu chuyển sang màu nâu đỏ. Công thức của muối sodium là
vào ống thứ hai, lắc nhẹ, thêm 1 mL benzene và lắc đều, lớp benzene từ không màu chuyển sang màu nâu đỏ. Công thức của muối sodium là
NaBr.
NaF.
NaCl.
NaI.
Phát biểu nào sau đây liên quan đến halogen halide (HX) là không đúng?
Các halogen halide dễ tan trong nước phân li hoàn toàn thành H+ và ![]() .
.
Tính acid của các hydrogen halide tăng từ HF đến HI.
Dung dịch HBr 0,01 M làm quỳ tím chuyển sang màu đỏ.
Liên kết H−I kém bền nhất trong các liên kết H−X.
Dung dịch nào sau đây có thể phân biệt hai dung dịch NaF và NaCl?
HCl.
HF.
![]()
![]()
Hydrochloric acid loãng thể hiện tính oxi hoá khi tác dụng với chất nào sau đây?
Fe.
![]()
![]()
![]()
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Những phát biểu sau đây:
a. Khi cho potassium bromide rắn phản ứng với sulfuric acid đặc thu được khí hydrogen bromide.
b. Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H-F bền nhất trong các liên kết H-X.
c. Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
d. Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Thuỷ tinh vốn cứng, trơn và khá trơ về mặt hoá học nên việc chạm khắc là điều không đơn giản. Muốn khắc các hoa văn, cần phủ lên bề mặt thuỷ tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thuỷ tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp ![]() và
và ![]() đặc lên lớp paraffin đó, phần thuỷ tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí.
đặc lên lớp paraffin đó, phần thuỷ tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí.
HF là là acid mạnh và có tính chất đặc biệt là ăn mòn thuỷ tinh.
b. Phương trình hoá học của phản ứng ăn mòn thủy tinh là: ![]()
c. Để bảo quản hydrofluoric acid, người ta chứa trong bình bằng nhựa.
d. Tất cả các hydrohalic acid đều có khả năng ăn mòn thủy tinh.
Trong dịch vị dạ dày của người có hydrohalic acid X với nồng độ khoảng ![]() đến
đến![]() mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
a. X là hydrochloric acid.
b. Dung dịch hydrohalic acid X làm quỳ tím chuyển màu đỏ.
c. Hydrohalic acid X được dùng để tẩy rửa gỉ sét trên bề mặt gang, thép.
d. Hydrohalic acid X là một acid yếu.
Natri clorid 0,9%” là nước muối sinh lí chứa sodium chloride (NaCl), nồng độ 0,9% tương đương các dịch trong cơ thể người như máu, nước mắt, … thường được sử dụng để súc miệng, sát khuẩn, …
a. Rót nước sạch vào cốc đến vạch thể tích mong muốn, cho muối vào, khuấy đều đến khi nếm thấy độ mặn vừa phải thì dừng lại, thu được nước muối sinh lí 0,9%.
b. Natri chlorid 0,9% được lấy từ nước biển ngoài khơi xa ở độ sâu 500 m để đảm bảo độ tinh khiết.
c. NaCl là hợp chất ion, dễ tan trong nước.
d. Cách pha chế 500 mL nước muối sinh lí trên: cân 0,9 g tinh thể NaCl sạch, cho vào cốc có vạch chia thể tích 500 mL, thêm nước vào cốc đến đủ thể tích 500 mL, khuấy đều (biết ![]() ).
).
Nhiệt độ sôi của các hydrogen halide được biểu diễn qua đồ thị sau:
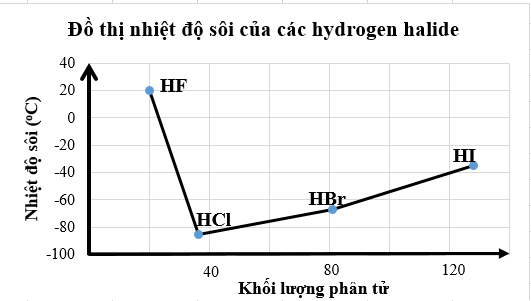
a. Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
b. Nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại là do lực tương tác van der Waals của HF lớn hơn.
c. Nhiệt độ sôi tăng dần từ HF đến HI do khối lượng phân tử tăng dẫn đến tương tác van der Waals tăng.
d. Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI là do khối lượng phân tử tăng dẫn đến liên kết hydrogen liên phân tử tăng dần.
Dung dịch hydrochloric acid phản ứng với calcium carbonate theo sơ đồ sau đây:
![]()
a. Phản ứng có sinh ra chất khí là ![]()
b. Tổng hệ số cân bằng (nguyên, tối giản) của tất cả các chất trong phản ứng bằng 6.
c. Khi tham gia phản ứng nguyên tử Cl trong HCl có số oxi hoá không đổi sau phản ứng.
d. Phản ứng trên chứng tỏ acid H2CO3 mạnh hơn acid HCl.
Cho bảng giá trị năng lượng liên kết ![]() dưới đây:
dưới đây:
F - F | H - H |
| H - F | O - H |
159 | 436 | 498 | 565 | 464 |
Liên kết bền nhất là?
Hydrochloric acid (HCl) là một acid mạnh được sử dụng trong các ngành công nghiệp sản xuất phân bón, thuốc nhuộm, ... Nó cũng được sử dụng trong các ngành công nghiệp mạ điện, chiết xuất ảnh, cao su và dệt may. Cho dung dịch acid HCl tác dụng với các chất sau: Zn, Cu, ![]() FeO. Số chất phản ứng được với dung dịch HCl là bao nhiêu?
FeO. Số chất phản ứng được với dung dịch HCl là bao nhiêu?
Biến thiên enthalpy tạo thành chuẩn của các halogen halide được cho trong bảng sau:
Chất | HF(g) | HCl(g) | HBr(g) | HI(g) |
| -273,3 | -92,3 | -36,3 | 26,5 |
a) Trong phản ứng giữa halogen và hydrogen, nhiệt lượng tỏa ra tăng dần từ F2 đến I2.
b) Trong phân hủy HI: 2HI(g) → H2(g) + I2(g) là phản ứng tỏa nhiệt.
c) Phản ứng H2(g) + Cl2(g) → 2HCl(g) có ![]()
d) Năng lượng liên kết HX giảm dần từ H – F đến H – I.
Có bao nhiêu phát biểu sai trong các phát biểu trên?
Cho các chất sau: KF, KOH, KCl, KBr, KI, KMnO4. Có bao nhiêu chất bị oxi hóa khi tác dụng với dung dịch sulfuric acid đặc?
X là một loại muối chloride, là nguyên liệu quan trọng trong công nghiệp hóa chất để điều chế ![]() NaOH, nước Javel,.. đặc biệt quan trọng trong bảo quản thực phẩm và làm gia vị thức ăn. X là?
NaOH, nước Javel,.. đặc biệt quan trọng trong bảo quản thực phẩm và làm gia vị thức ăn. X là?
Cách thu khí hydrogen halide trong phòng thí nghiệm phù hợp là cách ở hình nào?
|
|
|
Hình 1 | Hình 2 | Hình 3 |
Cho các chất sau: Fe, Cu, Mg, Fe2O3. Số chất tác dụng với dung dịch HCl là?
Cho các phương trình phản ứng sau:
a. HCl + NaOH → NaCl + H2O.
b. 2HCl + Mg → MgCl2 + H2.
c. MnO2 + 4HCl ![]() MnCl2 + Cl2 + 2H2O.
MnCl2 + Cl2 + 2H2O.
d. NH3 + HCl → NH4Cl.
e. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Số phản ứng trong đó HCl đóng vai trò chất khử là bao nhiêu?