30 bài tập Năng lượng hóa học có đáp án
30 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
![]()
Phát biểu nào sau đây không đúng?
Biến thiên enthalpy chuẩn của phản ứng là -57,3 kJ.
Phản ứng trên là phản ứng tỏa nhiệt.
Nhiệt tạo thành chuẩn của NaCl (aq) là -57,3 kJ/mol.
Phản ứng trên giải phóng nhiệt năng ra môi trường.
Sự thay đổi nhiệt độ trong phản ứng của calcium với nước được minh họa trong hình bên dưới. Phản ứng của calcium với nước là
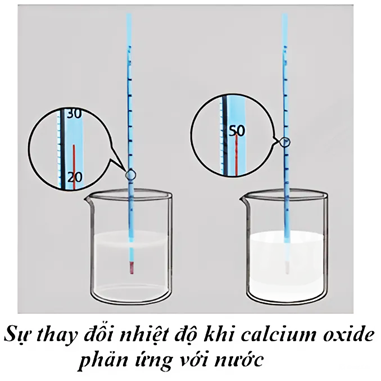
phản ứng thu nhiệt.
phản ứng phân hủy.
phản ứng tỏa nhiệt.
phản ứng thuận nghịch.
Cho phương trình nhiệt hóa học của các phản ứng sau:
(1) ZnO(s) + SO2(g) ![]() ZnSO4(s)
ZnSO4(s)![]() =
= ![]() 235,21 kJ
235,21 kJ
(2) 2Na(s) +2H2O(l)![]() 2NaOH(aq) + H2(g)
2NaOH(aq) + H2(g)![]() =
= ![]() 367,50 kJ
367,50 kJ
(3) CO2(g) ![]() CO(g) +
CO(g) + ![]() O2(g)
O2(g) ![]() = +280,00 kJ
= +280,00 kJ
(4) C3H8 (g) + 5O2 (g) ![]() 3CO2 (g) + 4H2O (l)
3CO2 (g) + 4H2O (l)![]()
Phản ứng thu nhiệt là
(1).
(2).
(4).
(3).
Kí hiệu biến thiên enthalpy (nhiệt phản ứng) của phản ứng ở điều kiện chuẩn là
![]()
![]()
![]()
![]()
Cho các phát biểu:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt.
(b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt.
(d) Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào.
Số phát biểu đúng là
2.
3.
4.
5.
Phương trình hóa học nào dưới đây là phương trình biểu thị enthalpy tạo thành chuẩn của một chất?
![]() N2(g) + O(g) → NO(g).
N2(g) + O(g) → NO(g).
Na(s) + ![]() Br2(g) → NaBr(s).
Br2(g) → NaBr(s).
N2(g) + O2(g) → 2NO(g).
4Na(s) + O2(g) → 2Na2O(s).
Chất nào sau đây có nhiệt tạo thành chuẩn (![]() ) bằng 0 (kJ/mol)?
) bằng 0 (kJ/mol)?
NaCl(s).
CO2(g).
H2O(l).
H2(g).
Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết (trong đó, kí hiệu ![]() là tổng năng lượng liên kết của các chất tham gia phản ứng; kí hiệu
là tổng năng lượng liên kết của các chất tham gia phản ứng; kí hiệu ![]() là tổng năng lượng liên kết của các chất sản phẩm phản ứng) là
là tổng năng lượng liên kết của các chất sản phẩm phản ứng) là
![]()
![]()
![]()
![]()
Phản ứng thu nhiệt là phản ứng có
A. ![]() .
.
D. ![]() .
.
Phát biểu nào sau đây đúng?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C.
Phương trình nhiệt hóa học nào sau đây là của phản ứng thu nhiệt ở điều kiện chuẩn?
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Một phản ứng có biến thiên enthalpy bằng 65 kJ. Phát biểu nào sau đây là đúng?
Cả phản ứng và môi trường xung quanh đều mất một năng lượng là 65 kJ.
Phản ứng nhận được 65 kJ năng lượng và môi trường xung quanh mất 65 kJ năng lượng.
Phản ứng mất 65 kJ năng lượng và môi trường xung quanh nhận được 65 kJ năng lượng.
Cả phản ứng và môi trường xung quanh đều thu được một năng lượng 65 kJ.
Biến thiên enthalpy chuẩn của phản ứng nào dưới đây chính là enthalpy tạo thành chuẩn của AlCl3(s)?
Al(s) + 3Cl2(g) → AlCl3(s).
Al(s) + 3Cl2(g) → 2AlCl3(s).
3HCl(aq) + Al(OH)3(s) → AlCl3(s) + 3H2O(l).
Al(s) + ![]() Cl2(g) → AlCl3(s).
Cl2(g) → AlCl3(s).
Khái niệm nào sau đây về enthalpy tạo thành chuẩn là chính xác nhất?
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền nhất ở điều kiện chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 2 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Enthalpy tạo thành chuẩn của các khí O3, CO2, NH3, HI lần lượt là 142,2 ![]()
![]()
![]() 26,5
26,5 ![]() Thứ tự độ bền tăng dần của các hợp chất trên là
Thứ tự độ bền tăng dần của các hợp chất trên là
![]()
![]()
![]()
![]()
Cho phản ứng chuyển hóa giữa hai dạng đơn chất của carbon:
C (kim cương) → C (graphite)![]()
Nhận xét nào sau đây là đúng?
Phản ứng thu nhiệt, kim cương bền hơn graphite.
Phản ứng thu nhiệt, graphite bền hơn kim cương.
Phản ứng tỏa nhiệt, kim cương bền hơn graphite.
Phản ứng tỏa nhiệt, graphite bền hơn kim cương.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Cho phương trình nhiệt hóa học sau:
H2(g) + Cl2(g) ![]() 2HCl(g)
2HCl(g) ![]()
a. Phản ứng trên gây nổ ngay trong bóng tối.
b. Khi tăng nồng độ HCl thì tốc độ phản ứng tăng.
c. Nhiệt tạo thành của HCl (g) là -93 kJ/mol.
d. Phản ứng trên là phản ứng tỏa nhiệt.
Trong y tế, nitrogen monoxide thường được biết đến là một loại khí hít được sử dụng với vai trò như một chất giảm đau và sử dụng để chăm sóc đặc biệt để thúc đẩy sự giãn nở của mao mạch và phổi. Cho phản ứng tổng hợp nitrogen monoxide từ ammonia có xúc tác plantinum như sau:
![]()
a. Phản ứng (1) là phản ứng thu nhiệt.
b. Phản ứng:![]() có
có ![]() = + 609kJ.
= + 609kJ.
c. Phản ứng (1) có năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm.
d. Phản ứng (1) xảy ra mạnh hơn khi tiến hành ở nhiệt độ và áp suất cao.
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hoá học sau:
2H2(g) + O2(g) ![]() 2H2O(g) (1)
2H2O(g) (1) ![]() = - 483,64 kJ
= - 483,64 kJ
a. Nhiệt tạo thành của H2O(g) là -483,64kJ/mol.
b. Tổng năng lượng của hỗn hợp 1 mol oxygen (gas) và 2 mol hydrogen (gas) có năng lượng lớn hơn năng lượng của 2 mol nước (hơi).
c. Phản ứng (1) là phản ứng tỏa nhiệt.
d. Khi tạo thành 27 gam nước (gas) thì phản ứng đã cung cấp cho môi trường một lượng nhiệt là 725,46KJ.
Cho bốn phản ứng sau:
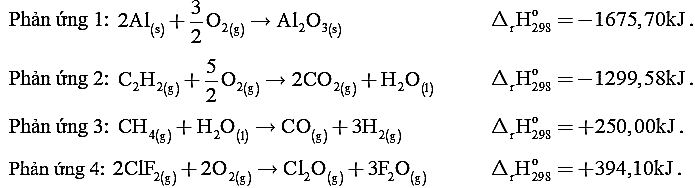
a. Phản ứng (4) làm cho nhiệt độ môi trường xung quanh giảm đi.
b. Phản ứng (2) thường được ứng dụng trong hàn kim loại.
c. Phản ứng (1) là phản ứng thu nhiệt.
d. Phản ứng (3) xảy ra dễ dàng và thuận lợi nhất.
Cho các phản ứng hóa học sau đây (ở điều kiện chuẩn):
(1) 2H2(g) + O2(g) → 2H2O(l)![]()
(2) CaCO3(s) → CaO(s) + CO2(g)![]()
(3) CaO(s) + H2O(l) → Ca(OH)2(aq)![]()
Mỗi phát biểu sau là đúng hay sai?
a. Các phản ứng (1) và (3) là phản ứng tỏa nhiệt.
b. Phản ứng (2) là phản ứng tỏa nhiệt.
c. Nhiệt tạo thành chuẩn của H2O(l) là -571,6 ![]()
d. Về mặt năng lượng, phản ứng (3) thuận lợi hơn phản ứng (1) và (2).
Cho phương trình nhiệt hóa học sau:
N2(g) + O2(g) ![]() 2NO(g)
2NO(g) ![]() = +179,20 kJ
= +179,20 kJ
a. Phản ứng trên là phản ứng thu nhiệt.
b. Biến thiên enthalpy tạo thành của N2 và O2 bằng 0.
c. Tổng enthalpy tạo thành của các chất tham gia phản ứng trên nhỏ hơn tổng enthalpy tạo thành của chất sản phẩm.
d. Để đốt cháy 2 mol N2 cần cung cấp nhiệt lượng là 179,2 kJ.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
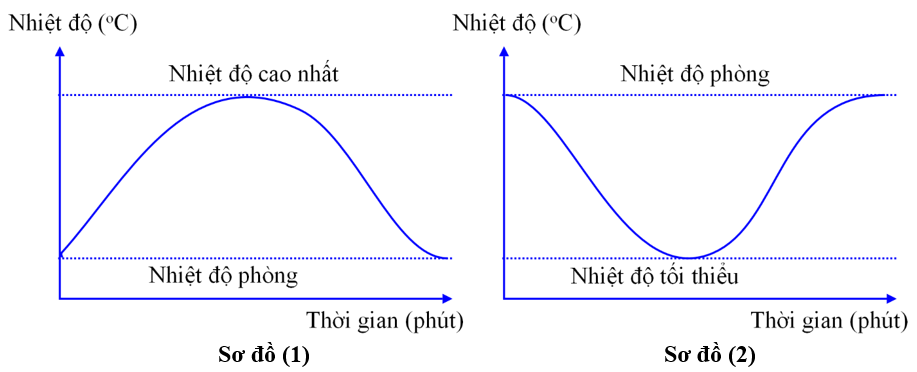
Cho 2 sơ đồ biểu diễn sự thay đổi nhiệt độ theo thời gian của phản ứng (1) và (2). Sơ đồ nào chỉ quá trình thu nhiệt?
Phương trình hóa học nào sau đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
(1) 2C (graphite)![]()
(2) C (graphite) + ![]()
(3) C (graphite)![]()
(4) C (graphite) ![]()
Cho các phương trình nhiệt hóa học của các phản ứng sau:
(1) 3Fe(s) + 4H2O(l) ® Fe3O4(s) + 4H2(g)![]() = +26,32 kJ
= +26,32 kJ
(2) N2(g) + O2(g) ® 2NO(g)![]() = +179,20 kJ
= +179,20 kJ
(3) Na(s) + 2H2O(l) ® NaOH(aq) + H2(g) ![]() = ‒ 367,50 kJ
= ‒ 367,50 kJ
(4) 2ZnS(s) + 3O2(g) ® 2ZnO(s) + 2SO2(g) ![]() = ‒285,66 kJ
= ‒285,66 kJ
Có bao nhiêu phản ứng thuộc loại phản ứng tỏa nhiệt?
Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng ở áp suất 1 atm và ![]()
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
(e) Các phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
(g) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
Có bao nhiêu phát biểu đúng?
Cho các phương trình nhiệt hóa học của các phản ứng sau:
(a) 3Fe(s) + 4H2O(l) ![]() Fe3O4(s) + 4H2(g) ;
Fe3O4(s) + 4H2(g) ;![]() = +26,32 kJ
= +26,32 kJ
(b) N2(g) + O2(g) ![]() 2NO(g);
2NO(g);![]() = +179,20 kJ
= +179,20 kJ
(c) Na(s) + 2H2O(l) ![]() NaOH(aq) + H2(g) ;
NaOH(aq) + H2(g) ;![]() = ‒ 367,50 kJ
= ‒ 367,50 kJ
(d) ZnSO4(s) ![]() ZnO(s) + SO3(g) ;
ZnO(s) + SO3(g) ;![]() = + 235,21 kJ
= + 235,21 kJ
(e) 2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g) ;
2ZnO(s) + 2SO2(g) ;![]() = ‒285,66 kJ
= ‒285,66 kJ
Số phản ứng thu nhiệt là bao nhiêu?
Cho sơ đồ biểu diễn biến thiên của phản ứng: CaCO3(s) → CaO(s) + CO2(g)
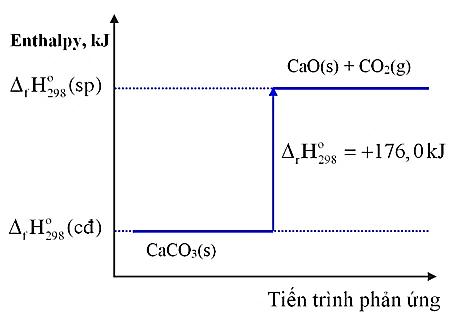
Phản ứng trên thuộc phản ứng thu nhiệt hay tỏa nhiệt?
Cho các phản ứng:
(1) CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g)![]() = + 178,49 kJ
= + 178,49 kJ
(2) C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l)![]() = -1370,70 kJ
= -1370,70 kJ
(3) C(graphite, s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = -393,51 kJ
= -393,51 kJ
Có mấy phản ứng không thể tự xảy ra (sau giai đoạn khơi mào ban đầu)?
Cho các đơn chất sau đây: C(graphite, s); Br2(l); Br2(g); Na(s); Hg(l); Hg(s). Số đơn chất có ![]() = 0?
= 0?








