100 bài tập Nitrogen và sulfur có đáp án
100 câu hỏi
Chủ đề 9. NITROGEN VÀ SULFUR
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Trong tự nhiên, đơn chất nitrogen có nhiều trong
nước biển.
không khí.
cơ thể người.
mỏ khoáng.
Diêu tiêu Chile (hay diêm tiêu natri) là tên gọi khác của hợp chất nào sau đây?
Sodium chloride.
Potassium sulfate.
Sodium nitrate.
Potassium nitrate.
Vị trí của nguyên tố N (Z = 7) trong bảng tuần hoàn các nguyên tố hóa học là
ô số 7, chu kì 3, nhóm VA.
ô số 3, chu kì 2, nhóm VIA.
ô số 7, chu kì 2, nhóm VIA.
ô số 7, chu kì 2, nhóm VA.
Đặc điểm cấu tạo của phân tử N2 là
có 1 liên kết ba.
có 1 liên kết đôi.
có 2 liên kết đôi.
có 2 liên kết ba.
Trong hợp chất nitrogen có các mức oxi hóa nào sau đây?
-3, +3, +5
-3, 0, +3, +5.
-3, +1, +2, +3, +4, +5.
-3, 0, +1, +2, +3, +4, +5.
Tính chất nào sau đây không phải tính chất vật lí của N2?
Chất khí.
Không màu.
Nặng hơn không khí.
Tan ít trong nước.
Trong phản ứng: N2(g) + 3H2(g) ![]() 2NH3(g). N2 thể hiện
2NH3(g). N2 thể hiện
tính khử.
tính oxi hóa.
tính base.
tính acid.
Trong phản ứng: N2(g) + O2(g) ![]() 2NO(g). N2 thể hiện
2NO(g). N2 thể hiện
tính khử.
tính oxi hóa.
tính base.
tính acid.
Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do
nitrogen có bán kính nguyên tử nhỏ.
nitrogen có độ âm điện lớn.
phân tử nitrogen có liên kết ba bền vững.
phân tử nitrogen không phân cực.
Khí nitrogen ít tan trong nước là do
nitrogen có bán kính nguyên tử nhỏ.
nitrogen có độ âm điện lớn.
phân tử nitrogen có liên kết ba bền vững.
phân tử nitrogen không phân cực.
Liên kết hoá học trong phần tử NH3 là liên kết
cộng hoá trị có cực.
ion.
cộng hoá trị không cực.
kim loại.
Dạng hình học của phân tử ammonia là
hình tam giác đều.
hình tứ diện.
đường thẳng.
hình chóp tam giác.
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
màu hồng.
màu vàng.
màu đỏ.
màu xanh.
Tính chất hóa học của NH3 là
tính base, tính khử.
tính base, tính oxi hóa.
tính acid, tính base.
tính acid, tính khử.
Dung dịch NH3 phản ứng được với dung dịch nào sau đây?
NaOH.
KCl.
HCl.
KOH
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây làm bột nở?
(NH4)2SO4.
NH4HCO3.
CaCO3.
NH4NO2.
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
NH3.
H2.
NO2
NO.
Phương trình hóa học nào sau đây sai?
![]()
![]()
![]()
![]()
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein.
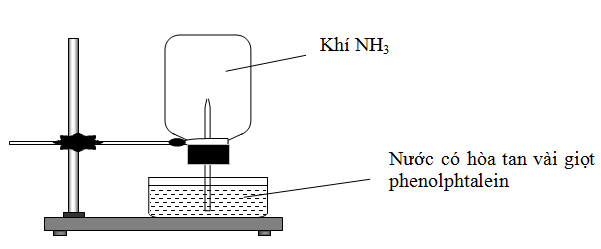
Hiện tượng xảy ra trong thí nghiệm là
Nước phun vào bình và chuyển thành màu hồng.
Nước phun vào bình và chuyển thành màu tím.
Nước phun vào bình và không có màu.
Nước phun vào bình và chuyển thành màu xanh.
Có thể dùng chất nào sau đây để làm khô khí ammonia?
Dung dịch H2SO4 đặc.
P2O5 khan.
MgO khan.
CaO khan.
Oxide phổ biến của nitrogen trong không khí là
NO, N2O.
NO, NO2.
N2O3, NO2.
NO, N2O4.
Nitrogen dioxide là tên gọi của oxide nào sau đây?
NO.
NO2.
N2O.
N2O4.
Mưa acid là hiện tượng tượng nước mưa có pH như thế nào?
> 5,6.
< 7.
> 7.
< 5,6.
Tác nhân chính gây ra hiện tượng mưa acid là
CO, SO2.
NOx, SO2.
NH3, NO2.
CO, NH3.
Cho iron(III) oxide tác dụng với nitric acid thì sản phẩm thu được là
Fe(NO3)3, NO và H2O.
Fe(NO3)3, NO2 và H2O.
Fe(NO3)3, N2 và H2O.
Fe(NO3)3 và H2O.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng nào trong các nguồn nước?
N,C.
N, K.
N, P.
P, K.
Hoạt động nào sau đây góp phần gây nên hiện tượng phú dưỡng?
Sự quang hợp của cây xanh.
Nước thải sinh hoạt thải trực tiếp vào nguồn nước chưa qua xử lí.
Ao hồ thả quá nhiều tôm, cá.
Khử trùng ao hồ sau khi tát cạn bằng vôi sống (CaO).
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường chuyển sang màu vàng là do
HNO3 tan nhiều trong nước.
khi để lâu thì HNO3 bị khử bởi các chất của môi trường
dung dịch HNO3 có tính oxi hóa mạnh.
dung dịch HNO3 có hoà tan một lượng nhỏ NO2.
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Các hệ số a, b, c, d, e là những số nguyên tối giản nhất. Tổng (a + b) bằng
3.
5.
4.
6.
Phản ứng giữa kim loại magie với nitric acid loãng giải phóng khí dinitrogen oxide. Tổng các hệ số trong phương trình hóa học bằng là
10.
18.
24.
20.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Nitrogen có nhiều ứng dụng trong đời sống và sản xuất.
a. Phần lớn nitrogen được dùng để tổng hợp NH3, từ đó sản xuất phân đạm, nitric acid, …
b. Nitrogen lỏng có nhiệt độ thấp nên thường dùng để dập tắt đám cháy do xăng dầu.
c. Ở điều kiện thường, nitrogen trơ về mặt hóa học nên thường dùng để bảo quản máu và các mẫu sinh vật học khác.
d. Trong các gói bim bim thường được bơm khí nitrogen để bảo quản tốt hơn không khí.
Xét các phát biểu về đơn chất nitrogen.
a. Chất khí, màu trắng và nhẹ hơn không khí.
b. Hóa hợp với oxygen ở nhiệt độ cao hoặc tia lửa điện.
c. Thể hiện tính khử mạnh ở điều kiện thường.
d. Khó hóa lỏng và ít tan trong nước.
Xét các phát biểu sau về nitrogen.
a. Nguyên tử nguyên tố nitrogen có cấu hình electron là 1s22s22p3.
b. Ở trạng thái cơ bản, nguyên tử nitrogen có 3 electron hóa trị.
c. Nguyên tố nitrogen thuộc chu kì 2, nhóm VA trong bảng tuần.
d. Trong một số hợp chất, nguyên tử nitrogen có thể dùng cặp electron hóa trị riêng để tạo một liên kết cho – nhận với nguyên tử khác.
Cho các phát biểu về cấu tạo và tính chất vật lí của NH3.
a. Ở điều kiện thường, NH3 là chất khí không màu, không mùi.
b. Khí NH3 nặng hơn không khí.
c. Khí NH3 dễ hoá lỏng, ít tan trong nước.
d. Phân tử NH3 chứa các liên kết cộng hoá trị phân cực.
Xét tính base của dung dịch NH3.
a. Dung dịch NH3 có tính base yếu, không làm đổi màu quỳ tím.
b. Dung dịch ammonia có phản ứng với dung dịch acid để tạo muối ammonium.
c. Khi cho dung dịch NH3 tác dụng với dung dịch HCl loãng thấy xuất hiện khói trắng.
d. Cho dung dịch FeCl3 tác dụng với dung dịch NH3 thấy xuất hiện kết tủa nâu đỏ.
Cho các ứng dụng về ammonia.
a. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
b. Do có hàm lượng nitrogen cao nên ammonia được sử dụng làm phân đạm rất hiệu quả.
c. Trong các gói snack thường được bơm khí ammonia để bảo quản.
d. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Cho các phát biểu về muối ammonium.
a. Muối ammonium gồm cation ammonium và anion hydroxide.
b. Muối ammonium đều dễ tan trong nước, khi tan trong nước phân li hoàn toàn thành ion.
c. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
d. Khi nhiệt phân các muối ammonium luôn có khí NH3 thoát ra.
Cho các tính chất của nitric acid.
a. Nitric acid tinh khiết là chất lỏng không màu, có tính acid mạnh và tính oxi hóa mạnh.
b. Nitric acid bốc khói mạnh trong không khí ẩm và tan ít trong nước.
c. Dung dịch HNO3 đặc thường có màu nâu do HNO3 kém bền phân hủy một phần thành NO2.
d. Dung dịch nitric acid đặc thường được bảo quản trong lọ tối màu.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu,… phát triển nhanh.
a. Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
b. Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
c. Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh vì có nguồn chất dinh dưỡng phong phú.
d. Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Xét tính chất của nitrogen và hợp chất của nitrogen
a. NH3 và HNO3 đều dễ tan trong nước.
b. HNO3 và NH4Cl đều là acid mạnh trong nước.
c. N2 và HNO3 đều có tính oxi hóa mạnh ở điều kiện thường.
d. KNO3 và NH4NO3 đều bị phân hủy bởi nhiệt.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Cho sơ đồ chuyển hóa nitrogen trong khí quyển thành phân đạm:
![]()
Có bao nhiêu phản ứng thuộc loại oxi hóa – khử trong sơ đồ trên?
Cho dung dịch HNO3 tác dụng với các chất sau: NH3, CaCO3, Ag, NaOH. Có bao nhiêu phản ứng trong đó HNO3 đóng vai trò acid theo Bronsted - Lowry?
Cho các chất: Cu, Al, MgO, Fe3O4, Fe(OH)2, CaCO3, K2SO4 lần lượt tác dụng với dung dịch HNO3 loãng. Có bao nhiêu trường hợp xảy ra phản ứng oxi hóa – khử?
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO2↑ + eH2O. Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng bao nhiêu?
Cho từ từ đến dư dung dịch ammonia đặc lần lượt vào các ống nghiệm chứa mỗi dung dịch sau: MgCl2, AgNO3, AlCl3, CuSO4, Na2SO4. Số ống nghiệm xuất hiện kết tủa là?
Trong nước thải chứa các chất tan: urea, saccharose, NaCl, Na2CO3, NaHCO3, NH4NO3, ethanol, (NH4)2HPO4, Ca(H2PO4)2. Nếu nước thải trên chảy vào vùng nước tù thì có bao nhiêu chất có thể gây nên hiện tượng phú dưỡng?
Cho sơ đồ phản ứng sau:
![]()
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng mà nguyên tố nitrogen đóng vai trò chất khử là bao nhiêu?
Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O – H phân cực về oxygen.
(b) Nguyên tử N có số oxi hóa là +5.
(c) Nguyên tử N có hóa trị bằng IV.
(d) Phân tử HNO3 chứa liên kết cho – nhận N→O.
Có bao nhiêu nhận định đúng?
Nhiệt phân các muối ammonium: NH4Cl, (NH4)2CO3, NH4NO2, NH4HCO3, NH4NO3. Có bao nhiêu trường hợp thu được khí NH3?
Tiến hành thí nghiệm trộn từng cặp dung dịch sau: (a) NH3 và AlCl3; (b) (NH4)2SO4 và Ba(OH)2; (c) NH4Cl và AgNO3; (d) NH3 và HCl. Sau khi phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
Chủ đề 9.2. Đơn chất sulfur và một số hợp chất của sulfur
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Cấu hình electron lớp ngoài cùng của nguyên tử sulfur là
3s2 3p4.
2s2 2p4.
3s2 3p6.
2s2 2p6.
Nguyên tố sulfur có số hiệu nguyên tử là 16. Vị trí của sulfur trong bảng tuần hoàn các nguyên tố hóa học là
chu kì 3, nhóm VIA.
chu kì 5, nhóm VIA
chu kì 3, nhóm IVA.
chu kì 5, nhóm IVA.
Các số oxi hóa thường gặp của sulfur là
-2; -1; 0; +4.
-2; 0; +4; +6.
0; +4; +6; +8.
0; +3; +5; +7.
Ở điều kiện thường, phân tử đơn chất sulfur gồm số nguyên tử là
2.
4.
6.
8.
Trong số các chất khí: SO2, H2, O2, NH3, khí tan trong nước tạo dung dịch acid là
O2.
H2.
SO2.
NH3.
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất nào sau đây?
Fe.
O2.
H2.
Hg.
Ở điều kiện thích hợp, sulfur dioxide đóng vai trò là chất oxi hóa khi tham gia phản ứng với chất nào sau đây?
NO2.
H2S.
NaOH.
Ca(OH)2.
Chất được dùng để tẩy trắng giấy và bột giấy trong công nghiệp là
N2O.
CO2.
SO2.
NO2.
Khí nào sau đây có khả năng làm mất màu nước bromine?
N2.
CO2.
H2.
SO2.
Thạch cao sống là một dạng tồn tại phổ biến của sulfur trong tự nhiên, được sử dụng làm nguyên liệu để sản xuất xi măng, phấn viết bảng, … Công thức của thạch cao sống là
BaSO4.
CaSO4.2H2O.
MgSO4.
CuSO4.5H2O.
Tính chất nào sau đây không phải tính chất vật lí của sulfur?
Màu vàng ở điều kiện thường.
Thể rắn ở điều kiện thường.
Không tan trong benzene.
Không tan trong nước.
Khi nhiệt kế thủy ngân vỡ, rắc chất bột nào sau đây lên thủy ngân rơi vãi sẽ chuyển hóa chúng thành hợp chất bền, ít độc hại?
Than đá.
Đá vôi.
Muối ăn.
Sulfur.
Sau khi điều chế, khí SO2 có lẫn hơi nước được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ sau:
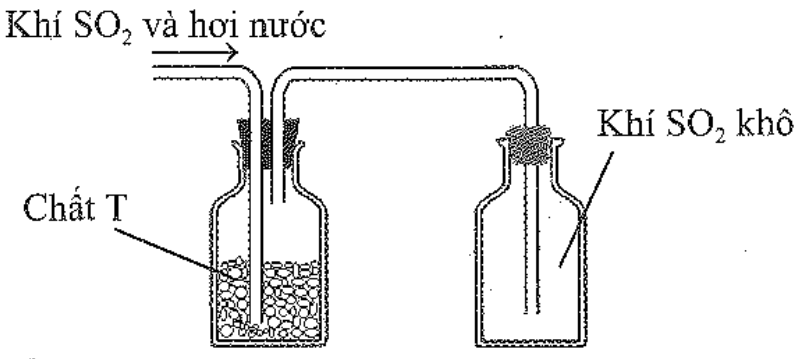
Chất T có thể là
KOH.
NaOH.
CaO.
P2O5.
Chất nào sau đây không bay hơi ở điều kiện thường do nhiệt độ sôi rất cao (337 oC)?
H2O.
![]()
NH3.
![]()
Quá trình pha loãng dung dịch đậm đặc của acid nào sau đây tỏa rất nhiều nhiệt nên không được tự ý pha loãng ?
HCl.
![]()
CH3COOH.
![]()
Ở thể lỏng, chất nào sau đây có dạng sánh như dầu do tồn tại liên kết hydrogen rất mạnh giữa các phân tử?
![]()
![]()
H2O.
CH3COOH.
Cách pha loãng dung dịch H2SO4 đặc nào sau đây đúng?
Rót nhanh acid vào nước và khuấy đều.
Rót nhanh nước vào acid và khuấy đều.
Rót từ từ nước vào acid và khuấy đều.
Rót từ từ acid vào nước và khuấy đều.
Trong công nghiệp sản suất sulfuric acid, sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc tạo thành oleum có công thức chung là
![]()
![]()
![]()
(SO3)n.
Trong các chất sau, chất nào phản ứng được với dung dịch H2SO4 loãng?
CuS.
FeS.
S.
Cu.
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
Al.
Zn.
Na.
Cu.
Các khí sinh ra trong thí nghiệm phản ứng của saccharose (C12H22O11) với dung dịch H2SO4 đặc bao gồm:
H2S và CO2.
H2S và SO2.
SO3 và CO2.
SO2 và CO2.
Dung dịch sulfuric acid đặc khác dung dịch sulfuric acid loãng ở tính chất hóa học nào?
Tính base mạnh.
Tính oxi hóa mạnh.
Tính acid mạnh.
Tính khử mạnh.
Trong công nghiệp, hydrogen fluoride được điều chế từ quặng fluorite theo phản ứng: ![]() . Vai trò của sulfuric acid trong phản ứng là
. Vai trò của sulfuric acid trong phản ứng là
base.
chất oxi hóa.
acid.
chất khử.
Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc?
Tính háo nước.
Tính oxi hóa.
Tính acid.
Tính khử.
Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
Ba(OH)2.
BaCl2.
Ba(NO3)2.
MgCl2.
Muối X không tan trong nước và các dung môi hữu cơ. Trong y học, X thường được dùng làm chất cản quang xét nghiệm X-quang đường tiêu hóa. Công thức của X là
BaSO4.
Na2SO4.
K2SO4.
MgSO4.
Cho phản ứng: S + 2H2SO4 ![]() 3SO2 + 2H2O. Tỉ lệ giữa số nguyên tử sulfur bị khử và số nguyên tử sulfur bị oxi hoá là
3SO2 + 2H2O. Tỉ lệ giữa số nguyên tử sulfur bị khử và số nguyên tử sulfur bị oxi hoá là
1: 2.
1: 3.
3: 1.
2: 1.
Trong công nghiệm sản xuất sulfuric acid, hai nguồn nguyên liệu được khai thác từ mỏ để cung cấp nguyên tố sulfur là
ZnS, PbS.
H2S, SO2.
CaSO4, BaSO4.
S, FeS2.
Khi trộn dung dịch Na2SO4 với dung dịch BaCl2, phản ứng thực chất xảy ra trong dung dịch là
![]()
![]()
![]()
![]()
Cho các nguyên liệu sau: sulfur, quặng pyrite (FeS2), không khí, nước, vanadium (V)oxide (V2O5). Số nguyên liệu được sử dụng trong công nghiệp sản xuất sulfuric acid là
4.
2.
5.
3.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Cho các phát biểu sau về sulfur.
a. Sulfur là một nguyên tố phi kim, chỉ có tính khử.
b. Khi tham gia phản ứng, sulfur thể hiện tính oxi hoá hoặc tính khử.
c. Ở điều kiện thường, sulfur là chất rắn, màu vàng, tan trong nước.
d. Ở điều kiện thường, sulfur tồn tại dạng phân tử gồm tám nguyên tử (![]() ).
).
Cho các phát biểu sau về tính chất hóa học của SO2.
a. Khi phản ứng với Mg thì SO2 thể hiện tính khử.
b. Khi tác dụng với O2 thì SO2 thể hiện tính oxi hóa.
c. SO2 là một acidic oxide.
d. SO2 có thể tác dụng với dung dịch base tạo thành muối và nước.
Cho cân bằng hóa học sau: SO2 (g) + ![]() O2 (g)
O2 (g) ![]() SO3 (g)
SO3 (g) ![]() = -99,2 kJ
= -99,2 kJ
a. Phản ứng thuận là phản ứng tỏa nhiệt.
b. Hằng số cân bằng của phản ứng thuận nghịch trên là ![]()
c. Khi giảm áp suất của hệ thì cân bằng trên chuyển dịch theo chiều thuận.
d. Trong thực tế, phản ứng thường được thực hiện ở nhiệt độ cao khoảng 600 oC.
Khi nhỏ vài giọt sulfuric acid đặc vào một xấp giấy ăn khô, giấy ăn sẽ hoá đen ở chỗ tiếp xúc, bốc cháy và tạo nhiều khói; khói này có thể làm đổi màu giấy quỳ tím ẩm.
a. Giấy ăn hoá đen (than hoá) là do cellulose trong giấy bị khử thành carbon.
b. Nếu thay giấy quỳ tím ẩm bằng giấy nhúng dung dịch KMnO4, giấy sẽ bị mất màu.
c. Trong khói sinh ra, có chứa sulfur trioxide là một acidic oxide.
d. Việc rò rỉ sulfuric acid trong quá trình lưu trữ không đúng cách có thể gây hoả hoạn.
Cho các phát biểu sau về quá trình sản xuất sulfuric acid bằng phương pháp tiếp xúc.
a. Chất xúc tác V2O5 giúp tăng hiệu suất phản ứng chuyển hoá SO2 thành SO3.
b. SO3 được hấp thụ bởi nước tạo thành H2SO4.
c. Nguyên liệu chính để sản xuất sulfuric acid là lưu huỳnh hoặc khoáng vật pyrite.
d. Phản ứng oxi hoá SO2 được thực hiện ở nhiệt độ thấp do có giá trị biến thiên enthalpy âm.
Cho dãy chuyển hoá dưới đây:
![]()
a. Có ba phản ứng mà nguyên tố lưu huỳnh đóng vai trò là chất khử.
b. Sản phẩm của phản ứng (4) có thể dùng làm phân bón.
c. Có thể phân biệt SO2 và SO3 chỉ bằng dung dịch BaCl2.
d. FeS2 là thành phần chính của quặng bauxite.
H2SO4 đặc gây nguy hiểm khi tiếp xúc với da nên cần lưu ý khi sử dụng và bảo quản.
a. Cần bảo quản H2SO4 trong chai lọ đậy chặt, đặt ở vị trí chắc chắn.
b. Khi làm thí nghiệm với H2SO4 đặc không cần đeo kính bảo hộ và áo thí nghiệm.
c. Khi bị bỏng H2SO4 đặc thì việc đầu tiên cần làm là nhanh chóng rửa ngay với nước lạnh nhiều lần.
d. H2SO4 đặc không quá nguy hiểm nên khi bị bỏng không cần thiết phải đến cơ sở y tế.
Cho các phát biểu về muối sulfate.
a. Muối (NH4)2SO4 dùng để sản xuất phân đạm, muối BaSO4 dùng sản xuất chất cản quang.
b. Muối CuSO4 được dùng để sản xuất thạch cao, muối MgSO4 làm dịu cơn đau cơ.
c. Để nhận biết ion ![]() trong dung dịch ta dùng Ba2+ trong Ba(OH)2, BaCl2, Ba(NO3)2.
trong dung dịch ta dùng Ba2+ trong Ba(OH)2, BaCl2, Ba(NO3)2.
d. Cho dung dịch BaCl2 vào dung dịch Na2SO4 thấy xuất hiện kết tủa vàng.
Cho công thức Lewis của H2SO4 như sau:
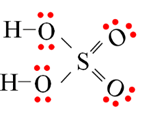
a. Số oxi hóa của S trong H2SO4 là +6.
b. H2SO4 là acid yếu, hai nấc.
c. Tổng số liên kết sigma trong H2SO4 là 4.
d. H2SO4 có thể tạo liên kết hydrogen liên phân tử.
Cho các hiện tượng quan sát được trong các thí nghiệm sau:
a. Cho dung dịch H2SO4 loãng tiếp xúc với lá kẽm (zinc) bị phủ bởi lớp zinc oxide thấy lớp oxide tan dần sau đó kim loại tan và có bọt khí xuất hiện.
b. Cho dung dịch H2SO4 loãng tiếp xúc với mẩu đá vôi thấy có khí không màu thoát ra, dung dịch thu được có màu xanh lam.
c. Cho dung dịch H2SO4 loãng tiếp xúc bột baking soda thấy bột baking soda tan ra, dung dịch sủi bọt khí, dung dịch thu được không màu.
d. Cho dung dịch H2SO4 loãng vào nước vôi trong Ca(OH)2 thấy nước vôi trong bị vẩn đục.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Cho S tác dụng với các chất H2, O2, F2, Fe, Zn, Hg. Có bao nhiêu phản ứng trong đó S đóng vai trò là chất oxi hóa?
Cho SO2 tác dụng với các chất H2O, BaO, H2S, Mg, KOH, O2, NO2. Có bao nhiêu phản ứng chứng tỏ SO2 là một acidic oxide?
Khi cho sulfuric acid đặc, nóng lần lượt tiếp xúc với các chất sau: đường saccharose (C12H22O11), bột lưu huỳnh, thanh platinum, bột kẽm, thuốc tím (KMnO4), muối ăn (NaCl). Số chất bị sulfuric acid đặc, nóng oxi hoá là?
Cho các chất: Ag, Fe, CuO, Fe2O3, NaOH, KNO3, CaCO3 lần lượt tác dụng với dung dịch H2SO4 loãng. Có bao nhiêu trường hợp xảy ra phản ứng?
Cho các chất: S, Cu, FeS, Fe2O3, FeO, Fe(OH)2, Mg(OH)2. Có bao nhiêu chất tác dụng với H2SO4 đặc, nóng, tạo khí?
Cho các kim loại: Al, Fe, Mg, Cu, Cr, Ag, Au, Pt. Có bao nhiêu kim loại không tan trong dung dịch H2SO4 đặc, nguội?
Cho các phát biểu sau:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid để tránh nguy hiểm.
(c) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là dung dịch chứa ion Ba2+.
Có bao nhiêu phát biểu đúng trong các phát biểu trên?
Cho các phát biểu sau:
(a) Sulfuric acid tan tốt trong nước, quá trình hòa tan tỏa nhiệt mạnh.
(b) Dung dịch sulfuric acid đặc hòa tan được tất cả các kim loại.
(c) Dung dịch sulfuric acid đặc có tính háo nước và tính oxi hóa mạnh.
(d) Dung dịch sulfuric acid loãng dễ bị phân hủy bởi ánh sáng nên kém bền.
Có bao nhiêu phát biểu đúng trong các phát biểu trên?
Cho sơ đồ phản ứng: H2SO4 + Fe ![]() Fe2(SO4)3 + H2O + SO2
Fe2(SO4)3 + H2O + SO2
Với hệ số cân bằng của phản ứng là các số nguyên tối giản, số phân tử H2SO4 bị khử và số phân tử H2SO4 tạo muối của phản ứng là?
Cho các chất: Cu, CuO, NaCl, Mg, KOH, C, Na2CO3. Số chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là?








