30 bài tập Cân bằng hóa học có đáp án
30 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Chất nào sau đây là chất không điện li?
A. ![]() .
.
![]()
![]()
D. ![]()
Đặc điểm nào sau đây không đúng về acid yếu?
Phân li một phần trong nước.
Có khả năng cho H+.
Dung dịch trong nước dẫn điện.
Có khả năng nhận H+.
Xét cân bằng sau diễn ra trong một piston ở nhiệt độ không đổi:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
Nếu nén piston thì cân bằng sẽ chuyển dịch theo chiều nào?
Chuyển dịch theo chiều nghịch.
Chuyển dịch theo chiều thuận.
Chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào tốc độ nén piston.
Không thay đổi.
Cho phản ứng sau: ![]() . Những chất nào đóng vai trò là acid theo thuyết Bronsted – Lowry?
. Những chất nào đóng vai trò là acid theo thuyết Bronsted – Lowry?
H2S và H2O.
H2S và H3O+.
H2S và ![]() .
.
H2O và H3O+.
Cho cân bằng: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g). Khi giảm nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là?
CO(g) + 3H2(g). Khi giảm nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là?
Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi giảm nhiệt độ.
Phương trình mô tả sự điện li của Ba(NO3)2 trong nước là
![]()
![]()
![]()
![]()
Đặc điểm nào sau đây không đúng về base mạnh?
Phân li hoàn toàn trong nước.
Có khả năng cho H+.
Dung dịch trong nước dẫn điện.
Có khả năng nhận H+.
Cặp chất nào sau đây là cặp acid – base liên hợp?
HCl, NaOH.
NH4Cl, NaOH.
H2SO4,![]()
KCN, HCN.
Cho cân bằng hoá học sau: 2SO2 (g) + O2 (g) ![]() 2SO3 (g)
2SO3 (g) ![]() < 0.
< 0.
Cho các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
(1), (2), (4), (5).
(2), (3), (5).
(2), (3), (4), (6).
(1), (2), (4).
Đặc điểm nhận biết phản ứng thuận nghịch ![]() đạt đến cân bằng là
đạt đến cân bằng là
tốc độ chuyển từ chất A thành chất B bằng với tốc độ chuyển từ chất B thành chất A.
chỉ 10% của chất A chuyển thành chất B.
chất A chuyển hoàn toàn thành chất B.
50% chất A chuyển thành chất B.
Cho phản ứng hoá học sau: H2(g) + Br2(g) ![]() 2HBr(g). Biểu thức hằng số cân bằng (KC) của phản ứng trên là
2HBr(g). Biểu thức hằng số cân bằng (KC) của phản ứng trên là
A. 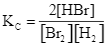 .
.
B. 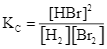 .
.
C. 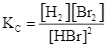 .
.
D. 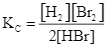 .
.
Cho các chất: CuSO4, NaOH, HCl, HNO3, NaNO3, saccharose (![]() ), ethanol, glycerol, KAl(SO4)2.12H2O. Trong các chất trên có bao nhiêu chất tạo được dung dịch dẫn điện?
), ethanol, glycerol, KAl(SO4)2.12H2O. Trong các chất trên có bao nhiêu chất tạo được dung dịch dẫn điện?
2.
3.
5.
6.
Cặp chất nào sau đây không phải là cặp acid – base liên hợp?
![]()
![]()
![]()
![]()
Đặc điểm nào sau đây là đặc trưng cho phản ứng thuận nghịch?
Số mol của chất phản ứng bằng với số mol của chất xúc tác.
Phản ứng có thể bị ảnh hưởng bởi chất xúc tác.
Hằng số cân bằng của phản ứng phụ thuộc vào nhiệt độ.
Trong suốt quá trình phản ứng luôn diễn ra theo hai chiều ngược nhau.
Cho cân bằng hóa học: CaCO3 (s) ![]() CaO (s) + CO2 (g). Biết phản ứng thuận là phản ứng thu nhiệt. Tác động nào sau đây làm cân bằng đã cho chuyển dịch theo chiều thuận?
CaO (s) + CO2 (g). Biết phản ứng thuận là phản ứng thu nhiệt. Tác động nào sau đây làm cân bằng đã cho chuyển dịch theo chiều thuận?
Tăng nồng độ khí CO2.
Tăng áp suất.
Giảm nhiệt độ.
Tăng nhiệt độ.
Trong phản ứng sau: ![]() , xác định các chất đóng vai trò acid và các chất đóng vai trò base theo Thuyết Brønsted – Lowry.
, xác định các chất đóng vai trò acid và các chất đóng vai trò base theo Thuyết Brønsted – Lowry.
: base; ![]() : acid.
: acid.
![]() : base;
: base; ![]() : acid.
: acid.
: acid; ![]() base.
base.
: acid; ![]() : base.
: base.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Cho biến thiên nồng độ chất phản ứng và chất sản phẩm theo thời gian như sau:
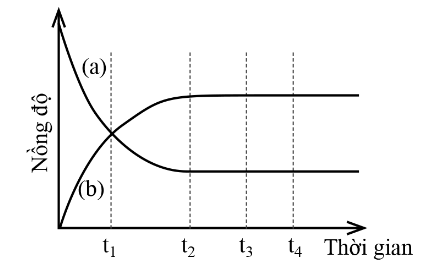
a. Đường (a) mô tả biến thiên nồng độ chất sản phẩm theo thời gian.
b. t1 không phải là thời điểm bắt đầu trạng thái cân bằng.
c. t2 là thời điểm phản ứng đạt trạng thái cân bằng.
d. Đường (b) mô tả biến thiên nồng độ chất phản ứng theo thời gian.
Hằng số cân bằng của phản ứng ![]() ở nhiệt độ 400 K và 500 K lần lượt là 50 và 1 700. Mỗi phát biểu sau là đúng hay sai?
ở nhiệt độ 400 K và 500 K lần lượt là 50 và 1 700. Mỗi phát biểu sau là đúng hay sai?
a. Đây là phản ứng thu nhiệt.
b. Đây là phản ứng toả nhiệt.
c. Nếu trộn 20 mol NO2(g) với 2 mol N2O4(g) ở 400 K, thì cân bằng chuyển dịch theo chiều nghịch.
d. Enthalpy của phản ứng có giá trị dương.
Cho cân bằng hoá học sau: 2NH3(g) ![]() N2(g) + 3H2(g). Khi tăng nhiệt độ của hệ thì tỉ khối của hỗn hợp so với hydrogen giảm.
N2(g) + 3H2(g). Khi tăng nhiệt độ của hệ thì tỉ khối của hỗn hợp so với hydrogen giảm.
a. Khi tăng nhiệt độ của hệ, cân bằng chuyển dịch theo chiều thuận.
b. Phản ứng thuận là phản ứng toả nhiệt.
c. Khi tăng áp suất của hệ, cân bằng chuyển dịch theo chiều nghịch.
d. Khi tăng nồng độ của NH3, cân bằng chuyển dịch theo chiều nghịch
Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanol acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH.
a. Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
b. Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị bằng 7.
c. Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
d. Trước khi chuẩn độ, pH của hai acid bằng nhau.
Cho cân bằng hoá học: 2SO2 (g) + O2 (g) ![]() 2SO3 (g)
2SO3 (g)![]()
a. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
b. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
c. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
d. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Mỗi phát biểu sau đây về thuyết Bronsted – Lowry là đúng hay sai?
a. Các ion tác dụng với nước nếu tạo ra ![]() là acid, nếu tạo ra
là acid, nếu tạo ra ![]() là base.
là base.
b. Tất cả mọi acid và base đều phân li hoàn toàn trong nước.
c. Base là một chất làm tăng nồng độ ion hydroxide trong nước.
d. Acid là chất có khả năng cho ![]() . Base là chất có khả năng nhận
. Base là chất có khả năng nhận ![]()
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Cho các chất sau đây: HCl, H2O, HNO3, HF, HNO2, KNO3, H2CO3, CH3COOH, H2S, Ba(OH)2. Số chất thuộc loại điện li yếu là bao nhiêu?
Quan sát hình sau và cho biết có bao nhiêu phát biểu đúng?
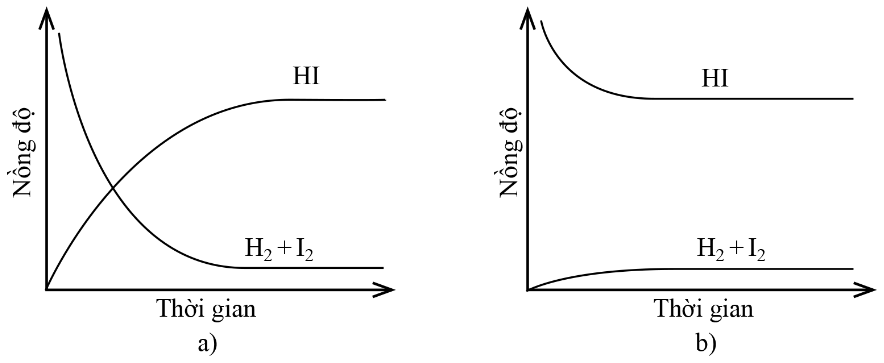
(a) Chỉ đồ thị (a) mô tả phản ứng đã đạt đến trạng thái cân bằng.
(b) Chỉ đồ thị (b) mô tả phản ứng đã đạt đến trạng thái cân bằng.
(c) Cả hai đồ thị đều mô tả phản ứng đã đạt đến trạng thái cân bằng.
(d) Cả hai đồ thị đều không mô tả phản ứng đã đạt đến trạng thái cân bằng.
Ở các vùng quê, người dân thường dùng phèn chua để làm trong nước nhờ ứng dụng của phản ứng thuỷ phân ion Al3+? Chất hay ion nào là acid trong phản ứng thuỷ phân Al3+?
Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thủy phân, còn cation kim loại trung bình và yếu bị thủy phân tạo môi trường acid, gốc acid yếu bị thủy phân tạo môi trường base. Dung dịch muối Na2CO3 có giá trị pH như thế nào?
Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ![]() nhận proton của nước để tạo thành HClO. Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
nhận proton của nước để tạo thành HClO. Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
Cho cân bằng hoá học sau: 2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
Cho các tác động: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng.
Có bao nhiêu tác động trên làm cân bằng trên chuyển dịch theo chiều thuận?
Cho các phát biểu sau, số phát biểu đúng là bao nhiêu?
(a) Để so sánh mức độ acid giữa các dung dịch có thể dựa vào nồng độ: dung dịch acid nào có nồng độ lớn hơn sẽ có tính acid mạnh hơn.
(b) Trong các dung dịch có cùng nồng độ, dung dịch nào có tính acid mạnh hơn sẽ có nồng độ ion H+ lớn hơn và pH lớn hơn.
(c) Trong các dung dịch có cùng nồng độ, dung dịch nào có nồng độ ion OH− lớn hơn và pH nhỏ hơn sẽ có tính base lớn hơn.
(d) Trong các dung dịch có cùng nồng độ, dung dịch nào có tính acid mạnh hơn sẽ có nồng độ ion ![]() lớn hơn và pH nhỏ hơn.
lớn hơn và pH nhỏ hơn.
(e) Trong các dung dịch có cùng nồng độ, dung dịch có nồng độ ion ![]() nhỏ và pH cao sẽ có tính acid yếu hơn.
nhỏ và pH cao sẽ có tính acid yếu hơn.
(g) Trong một dãy các dung dịch có cùng nồng độ được sắp xếp theo tính acid tăng dần thì nồng độ ion ![]() sẽ giảm dần và
sẽ giảm dần và ![]() tăng dần.
tăng dần.
Cho các dung dịch có cùng nồng độ: NaOH (1), H2SO4 (2), HCl (3), KNO3 (4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là?








