30 bài tập Cấu tạo nguyên tử có đáp án
30 câu hỏi
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Trong nguyên tử, khối lượng một hạt electron và một hạt proton lần lượt là ![]() g và
g và ![]() g. Khối lượng của một hạt proton gấp bao nhiêu lần khối lượng một hạt electron?
g. Khối lượng của một hạt proton gấp bao nhiêu lần khối lượng một hạt electron?
Khoảng 1836 lần.
Khoảng 5,4 lần.
Khoảng ![]() lần.
lần.
Khoảng 0,0005 lần.
Mọi vật thể đều được tạo nên từ các nguyên tử. Trong hầu hết các nguyên tử, hạt nhân chứa các loại hạt nào?
Neutron, photon.
Electron, neutron.
Proton, photon.
Proton, neutron.
Phổ khối lượng có thể được sử dụng để xác định hàm lượng các đồng vị bền của một nguyên tố. Phổ khối lượng của neon (Ne) được biểu diễn như hình bên dưới. Dựa vào phổ khối lượng, hãy cho biết nguyên tử khối trung bình của Ne là bao nhiêu?
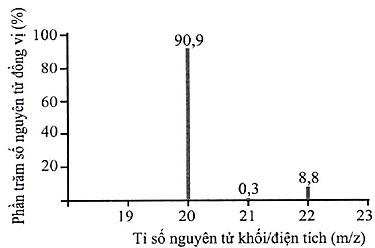
20,18.
21,82.
34,64.
21,00.
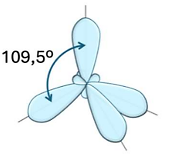
Hình nào dưới đây biểu diễn hình dạng các orbital lai hoá ![]() ?
?
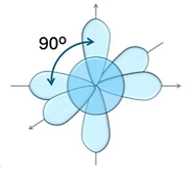
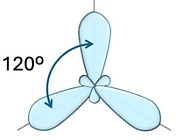
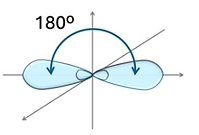
Hạt nhân nguyên tử Na có 11 proton và 12 neutron. Số electron trong nguyên tử Na là
23.
12.
11.
10.
Một trong số những phản ứng phổ biến nhất giữa ion và phân tử ở các đám khí trong vũ trụ là: ![]() Biết nguyên tử H có 1 eletron và 1 proton. Số proton, neutron và electron của ion
Biết nguyên tử H có 1 eletron và 1 proton. Số proton, neutron và electron của ion ![]() lần lượt là
lần lượt là
2p, 1n và 2e.
2p, 0n và 1e.
3p, 0n và 2e.
3p, 0n và 1e.
Nguyên tố X có số đơn vị điện tích hạt nhân là 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp nào?
K.
L.
M.
N.
Nhận xét nào sau đây không đúng về ![]()
Số khối là 206 amu.
Số neutron là 124.
Số đơn vị điện tích hạt nhân là 82.
Số proton và neutron là 82.
Khối lượng của nguyên tử magnesium là ![]() kg. Khối lượng của magnesium tính theo đơn vị amu là
kg. Khối lượng của magnesium tính theo đơn vị amu là
23,985.
![]()
23,978.
![]()
Nguyên tố X có số hiệu nguyên tử là 17. Cấu hình electron của ion ![]() là
là
![]()
![]()
![]()
![]()
Cho hình ảnh sau:
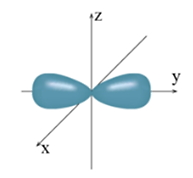
Hình ảnh trên biểu diễn hình dạng orbital nguyên tử (AO) nào sau đây?
s.
![]()
![]()
![]()
Trong tự nhiên, carbon có hai đồng vị bền là ![]() và
và ![]() ; oxygen có ba đồng vị bền là
; oxygen có ba đồng vị bền là ![]() và
và ![]() Số lượng tối đa loại phân tử
Số lượng tối đa loại phân tử ![]() có thể tạo ra từ các đồng vị này là
có thể tạo ra từ các đồng vị này là
Vô số.
12.
9.
6.
Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = 10), ở trạng thái cơ bản nguyên tử có ít electron độc thân nhất là
Ne.
F.
O.
N.
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
![]()
![]()
![]()
![]()
Phát biểu nào sau đây là đúng?
Electron trong cùng một lớp có năng lượng bằng nhau.
Electron trong cùng một phân lớp có năng lượng bằng nhau.
Electron ở các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
Electron ở lớp bên ngoài có năng lượng thấp hơn electron ở lớp bên trong.
Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron trong ion ![]() là
là
11 proton và 10 electron.
11 proton và 11 electron.
10 proton và 11 electron.
10 proton và 10 electron.
Số lượng electron độc thân của nguyên tử S (Z = 16) ở trạng thái cơ bản là
0.
1.
2.
6.
Số đồng vị bền của nguyên tố neon (Ne) được xác định từ phổ khối lượng ở hình bên dưới là
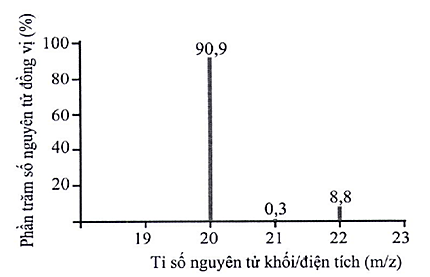
4.
3.
2.
1.
Phần 2. Trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d ở mỗi câu, học sinh chọn đúng hoặc sai.
Cho thí nghiệm bắn phá lá vàng bằng các hạt alpha (ion ![]() , kí hiệu là α) của Rutherford như sau:
, kí hiệu là α) của Rutherford như sau:
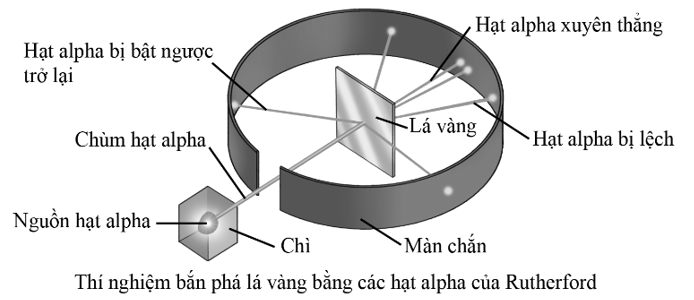
a. Hầu hết các hạt α xuyên thẳng qua lá vàng.
b. Nguyên tử hầu như đặc khít.
c. Không có hạt α nào bị bật ngược trở lại.
d. Hạt nhân nguyên tử cùng điện tích dương như hạt α.
Nguyên tử R có tổng số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm
a. Cấu hình electron nguyên tử R là ![]()
b. R có số khối là 35.
c. Nguyên tử R có 7 electron lớp ngoài cùng.
d. Nguyên tố R là phi kim và có 5 electron độc thân.
Ở trạng thái cơ bản, nguyên tử của một nguyên tố X có 2 electron ở lớp thứ nhất, 8 electron ở lớp thứ hai và 7 electron ở lớp thứ 3.
a. Số hiệu nguyên tử của nguyên tố X là 17.
b. X có tổng số electron trong các orbital s là 4.
c. Các electron ở lớp thứ ba của X phân bố vào 5 AO.
d. Tổng số electron trong các orbital p của X là 8.
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bord) và mô hình hiện đại của nguyên tử.
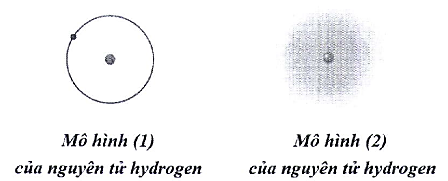
a. Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
b. Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
c. Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
d. Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Phần 3. Trắc nghiệm yêu cầu trả lời ngắn
Nguyên tử oxygen (O) có 8 electron. Theo mô hình Rutherford – Bohr, nguyên tử O có số electron cùng năng lượng ở lớp thứ nhất là bao nhiêu?
Cần ít nhất bao nhiêu orbital nguyên tử để chứa được 18 electron?
Phổ khối lượng của một mẫu lithium cho thấy nó chứa hai đồng vị là ![]() và
và ![]() với tỉ lệ phần trăm số nguyên tử mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hàng phần trăm) là bao nhiêu?
với tỉ lệ phần trăm số nguyên tử mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hàng phần trăm) là bao nhiêu?
Fluorine và hợp chất của nó được sử dụng làm chất chống sâu răng, chất cách điện, chất làm lạnh, vật liệu chống dính, …Nguyên tử fluorine chứa 9 electron và có số khối là 19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là bao nhiêu?
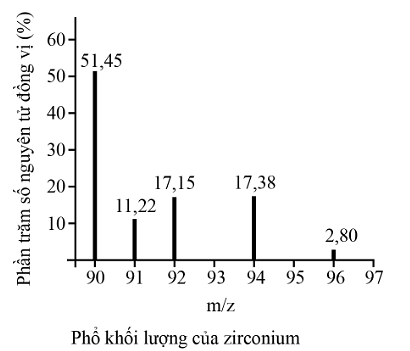
Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích z của các ion đồng vị zirconium đều bằng +1). Số lượng đồng vị bền của zirconium là bao nhiêu?
Cho cấu hình electron của ion ![]() là
là ![]() . Số hiệu nguyên tử của nguyên tố M bằng bao nhiêu?
. Số hiệu nguyên tử của nguyên tố M bằng bao nhiêu?
Nguyên tử chlorine (Z = 17) có bao nhiêu electron trong phân lớp 3p?
Đồng vị phóng xạ cobalt (Co - 60) phát ra tia γ có khả năng đâm xuyên mạnh, dùng để điều trị các khối u ở sâu trong cơ thể. Cobalt có ba đồng vị là: ![]() (chiếm 98%),
(chiếm 98%), ![]() và
và ![]() nguyên tử khối trung bình là 58,982. Xác định hàm lượng % của đồng vị phóng xạ Co - 60.
nguyên tử khối trung bình là 58,982. Xác định hàm lượng % của đồng vị phóng xạ Co - 60.








