30 bài tập Cấu tạo nguyên tử có đáp án
30 câu hỏi
TRẮC NGHIỆM
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
Proton.
Electron.
Proton và neutron.
Neutron.
Kí hiệu phân lớp electron nào sau đây là sai?
3s.
3p.
3d.
3f.
Phát biểu nào sau đây là đúng khi nói về nguyên tử?
Trong nguyên tử, số hạt proton luôn bằng số hạt neutron.
Điện tích của một nguyên tử có thể có giá trị âm, dương hoặc bằng 0.
Lớp vỏ nguyên tử tạo nên bởi các electron.
Khối lượng của một nguyên tử (tính theo amu) luôn là số nguyên.
Hình bên biểu diễn hình dạng orbital nguyên tử (AO) nào sau đây?
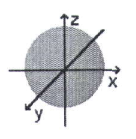
s.
B. ![]() .
.
![]()
![]()
Phát biểu nào sai khi nói về neutron?
Tồn tại trong hạt nhân nguyên tử.
Có khối lượng bằng khối lượng proton.
Có khối lượng lớn hơn khối lượng electron.
Không mang điện.
Số lượng electron tối đa có thể chứa trong lớp electron thứ ba là bao nhiêu?
2.
6.
10.
18.
Hình vẽ dưới đây mô tả 4 dạng orbital.
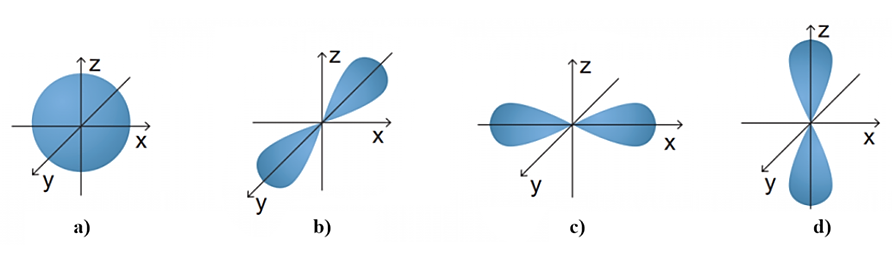
Các orbital tương ứng với các hình a), b) và c) là
![]()
![]()
![]()
![]()
Số đồng vị bền của nguyên tố neon (Ne) được suy ra từ phổ khối lượng ở hình bên là
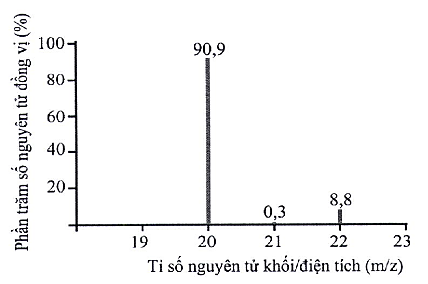
1.
2.
3.
4.
X là nguyên tố phổ biến thứ 4 trong vỏ trái đất, X có trong hemoglobin của máu làm nhiệm vụ vận chuyển oxygen, duy trì sự sống. Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.
(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là + 26.
(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
1.
2.
3.
4.
Số proton và số neutron có trong một nguyên tử aluminium (![]() ) lần lượt là
) lần lượt là
13 và 13.
12 và 14.
13 và 14.
13 và 15.
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lý hay quy tắc nào sau đây?
Nguyên lí Pauli và quy tắc Hund.
Nguyên lí vững bền và quy tắc Hund.
Nguyên lí vững bền và quy tắc Pauli.
Nguyên lí vững bền và nguyên lí Pauli.
Cách biểu diễn electron trong AO nào sau đây không tuân theo nguyên lí Pauli?
![]()
![]()
![]()
![]()
Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba. Thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng là: 1s 2s 2p 3s 3p 4s 3d... Cấu hình electron của nguyên tử Y là
![]()
![]()
![]()
![]()
Cho các phát biểu sau
(1) Phân lớp d có tối đa 10 electron.
(2) Phân lớp đã điền số electron tối đa được gọi là phân lớp electron bão hòa.
(3) Nguyên tử nguyên tố kim loại thường có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng.
(4) Nguyên tử nguyên tố khí hiếm thường có 5 hoặc 6 hoặc 7 electron ở lớp ngoài cùng.
(5) Các electron trên cùng một lớp có mức năng lượng bằng nhau.
(6) Ở trạng thái cơ bản, nguyên tử trung hòa điện.
Số phát biểu đúng là
4.
3.
2.
1.
Số lượng electron độc thân của nguyên tử S (Z = 16) là
0.
1.
2.
6.
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về
số neutron.
số proton.
số electron.
điện tích hạt nhân.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Một nguyên tử của một nguyên tố có 2 electron ở lớp thứ nhất, 8 electron ở lớp thứ 2 và 8 electron ở lớp thứ 3. Đối với nguyên tử này, mỗi phát biểu sau đúng hay sai?
a. Tổng số electron trong các orbital s là 2.
b. Tổng số electron trong các orbital p là 6.
c. Số hiệu nguyên tử của nguyên tố đó là 18.
d. Không thể xác định được số lượng neutron trong hạt nhân nguyên tử này.
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bord) và mô hình hiện đại của nguyên tử.
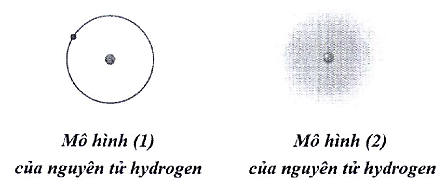
a. Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
b. Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
c. Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
d. Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Khi điền electron vào các lớp và phân lớp trong nguyên tử, mỗi phát biểu sau là đúng hay sai?
a. Electron được điền đầy hết các lớp bên trong rồi mới tới những lớp bên ngoài.
b. Thứ tự điền electron theo đúng thứ tự các lớp electron trong nguyên tử.
c. Mỗi orbital nguyên tử chỉ điền được tối đa 2 electron.
d. Số lượng electron tối đa có thể điền vào mỗi phân lớp là 2.
Nguyên tố hydrogen là một trong những nguyên tố phổ biến trong vũ trụ.
a. Là nguyên tố có đồng vị nhẹ nhất.
b. Là nguyên tố duy nhất có đồng vị mà hạt nhân chỉ tạo bởi các hạt p.
c. Nước chỉ tạo nên bởi các đồng vị ![]()
d. Hydrogen được xem là nguồn năng lượng xanh của tương lai.
Orbital nguyên tử (kí hiệu AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
a. Orbital 1s có dạng hình cầu, orbital 2s có dạnh hình số tám nổi.
b. Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s.
c. Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p.
d. Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần bằng năng lượng của electron thuộc AO 2p.
Orbital nguyên tử kí hiệu là AO (viết tắt của cụm từ tiếng anh: Atomic Orbital) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
a. Mỗi orbital nguyên tử có thể chứa tối đa hai electron.
b. Orbital 1s, 2s và 3s đều có dạng hình cầu.
c. Có thể có các orbital khác ngoài orbital s, p.
d. Các lớp electron khác nhau có cùng một số lượng orbital.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Cho sơ đồ biểu diễn cấu hình electron theo ô orbital của nguyên tử đó là
![]()
Tổng số electron trên các AO s là bao nhiêu?
Số hiệu nguyên tử của manganese là 25. Số electron hóa trị của manganese là bao nhiêu?
Nguyên tử Al (Z = 13) có bao nhiêu electron trong các phân lớp p?
Cho các cấu hình electron của các nguyên tử sau đây:
(a) ![]()
(b) ![]()
(c) ![]()
(d) ![]()
Có bao nhiêu nguyên tử là kim loại trong các nguyên tử bên trên?
Magnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng của cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích z của các ion đồng vị của magnesium đều bằng +2):
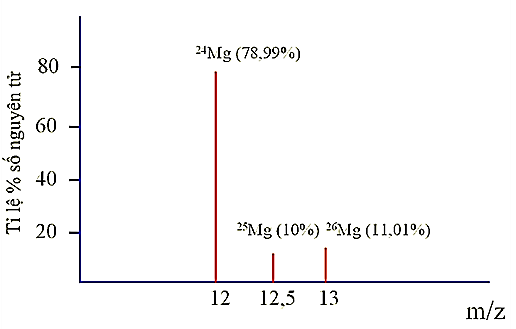
Magnesium có bao nhiêu đồng vị bền?
Ion ![]() là một trong số các ion phổ biến được tìm thấy trong vũ trụ. Tổng số hạt proton, neutron và electron của ion này là bao nhiêu?
là một trong số các ion phổ biến được tìm thấy trong vũ trụ. Tổng số hạt proton, neutron và electron của ion này là bao nhiêu?
Cho các phát biểu sau về phân lớp, lớp electron trong nguyên tử.
(a) Những electron ở lớp K có mức năng lượng thấp nhất.
(b) Trong nguyên tử, các electron được sắp xếp thành từng lớp. Mỗi lớp electron được chia thành các phân lớp.
(c) Các electron trên cùng một phân lớp có năng lượng khác nhau.
(d) Lớp n = 1 là lớp gần hạt nhân nhất.
(e) Các phân lớp được kí hiệu bằng chữ cái viết thường s, p, d, f, …
(f) Các electron trong cùng một lớp có mức năng lượng bằng nhau.
(g) Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
(h) Những electron ở gần hạt nhân có mức năng lượng cao nhất.
Số phát biểu đúng là bao nhiêu?
Một cation M+ và một anion X- có cùng cấu hình electron là ![]() M và X thuộc loại nguyên tố nào? (kim loại, phi kim hay khí hiếm).
M và X thuộc loại nguyên tố nào? (kim loại, phi kim hay khí hiếm).








