28 bài tập Liên kết hóa học có đáp án
28 câu hỏi
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử?
![]()
![]()
HF.
![]()
Liên kết hóa học là
sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
sự kết hợp của các phân tử hình thành các chất bền vững.
sự kết hợp của chất tạo thành vật thể bền vững.
Liên kết σ là liên kết được hình thành do
sự xen phủ bên của 2 orbital.
cặp electron chung.
lực hút tĩnh điện giữa hai ion.
sự xen phủ trục của hai orbital.
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 1 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
(Z = 12).
(Z = 9).
(Z = 11).
(Z = 10).
Cho bảng số liệu sau:
Chất | Nước ( | Hydrogen sulfide ( |
Nhiệt độ sôi ( | 100,0 | - 60,7 |
Phát biểu nào sau đây sai?
Liên kết O – H trong phân tử ![]() kém phân cực hơn liên kết S – H trong phân tử
kém phân cực hơn liên kết S – H trong phân tử ![]()
Số liên kết trong phân tử ![]() bằng số liên kết trong phân tử
bằng số liên kết trong phân tử ![]()
Trong phân tử ![]() và phân tử
và phân tử ![]() chỉ có các liên kết cộng hóa trị.
chỉ có các liên kết cộng hóa trị.
Do có liên kết hydrogen giữa các phân tử nên nước có nhiệt độ sôi cao hơn hydrogen sulfide.
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
![]()
![]()
![]()
![]()
Trong phân tử HF, số cặp electron dùng chung và cặp electron hóa trị riêng của nguyên tử F lần lượt là
1 và 4.
1 và 3.
3 và 1.
2 và 2.
Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình bền vững?
Nhận 5 electron, nhường 5 electron.
Nhận 3 electron, nhường 3 electron.
Nhường 3 electron, nhận 3 electron.
Nhường 5 electron, nhận 5 electron.
Trong phân tử carbon dioxide (CO2) số liên kết σ và liên kết π lần lượt là
4 và 0.
3 và 1.
2 và 2.
0 và 4.
Cho các hình biểu diễn sự xen phủ orbital nguyên tử để tạo liên kết hóa học sau:
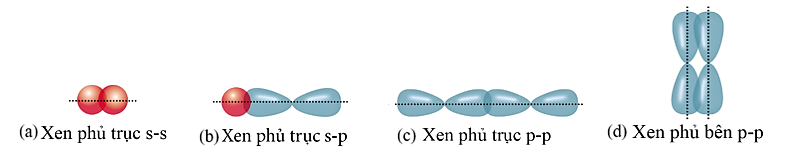
Biết số hiệu các nguyên tử của H, F và S lần lượt là 1, 9 và 16. Sự tạo thành liên kết trong các phân tử ![]() và
và ![]() theo kiểu xen phủ tương ứng là
theo kiểu xen phủ tương ứng là
(b) và (c).
(a) và (c).
(c) và (d).
(b) và (d).
Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.
Liên kết ion có bản chất là
sự dùng chung các electron.
lực hút tĩnh điện của các ion mang điện tích trái dấu.
lực hút tĩnh điện giữa cation kim loại với các electron tự do.
lực hút giữa các phân tử.
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
helium.
argon.
krypton
neon.
Cho các phân tử: ![]() Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
6.
5.
4.
3.
Hợp chất trong phân tử có liên kết ion là
![]()
![]()
HCl.
![]()
Cho các phát biểu sau về các loại liên kết:
(a) Liên kết ion mạnh hơn liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết cộng hóa trị.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Số phát biểu không đúng là
1.
2.
3.
4.
Phát biểu nào sau đây là không đúng?
Liên kết σ có thể tạo thành từ sự xen phủ trục của hai AO khác loại.
Liên kết σ bền vững hơn liên kết π.
Các AO p không có khả năng xen phủ tạo liên kết σ.
Các AO s chỉ có khả năng xen phủ tạo liên kết σ.
Magnesium oxide thường được sử dụng để lót bên trong các lò công nghiệp vì có nhiệt độ nóng chảy cao. Loại liên kết hay tương tác hóa học trong magnesium oxide là
tương tác van der Waals.
liên kết ion.
liên kết cộng hóa trị.
liên kết hydrogen.
Phân tử ![]() có cấu tạo như sau:
có cấu tạo như sau:
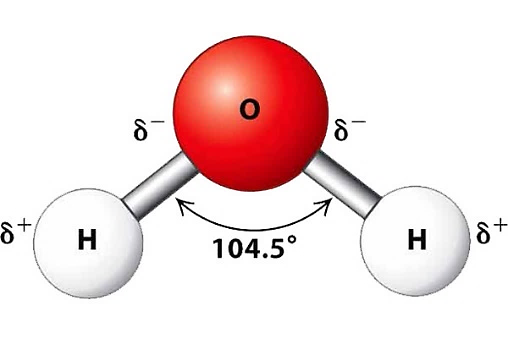
a. Liên kết H–O là liên kết cộng hoá trị không phân cực.
b. Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
c. Nguyên tử O còn một cặp electron hoá trị riêng.
d. Các phân tử H2O có khả năng tạo liên kết hydrogen với nhau.
Mỗi phát biểu sau là đúng hay sai?
a. Hiệu độ âm điện giữa hai nguyên tử càng cao thì liên kết càng phân cực.
b. Các phân tử halogen đều được tạo thành từ liên kết cộng hóa trị không phân cực.
c. Tất cả các nguyên tử khi tham gia tạo thành liên kết cộng hóa trị đều thỏa mãn quy tắc octet.
d. Các orbital p vừa có khả năng xen phủ tạo liên kết σ vừa có khả năng xen phủ tạo liên kết π tùy thuộc vào kiểu xen phủ.
Sodium fluoride (NaF) là thành phần hoạt chất phổ biến nhất trong kem đánh răng để ngăn ngừa sâu răng, hình thành men răng.
a. Trong phân tử NaF, các nguyên tử Na và F đều đã đạt cấu hình bền của khí hiếm gần nhất.
b. NaF là hợp chất cộng hóa trị phân cực.
c. Khi hình thành liên kết trong phân tử NaF, nguyên tử Na có xu hướng nhường 1 electron, nguyên tử F có xu hướng nhận 1 electron.
d. Nguyên tử Na có 2 electron hóa trị, nguyên tử F có 5 electron hóa trị.
Nguyên tố X tích luỹ trong tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. X thuộc loại nguyên tố s, nguyên tử X chỉ có 7 electron ở phân lớp s, nguyên tử Z chỉ có 17 electron ở phân lớp p.
a. X là sodium (Na), Z là bromine (Br).
b. Hợp chất tạo bởi X và Z là hợp chất ion.
c. Khi hình thành liên kết, nguyên tử X có xu hướng nhường 1 electron và nguyên tử Z có xu hướng nhận 1 electron.
d. Hợp chất tạo bởi X và Z tan tốt trong nước do tạo được liên kết hydrogen.
Phần 3. Trắc nghiệm yêu cầu trả lời ngắn
Có bao nhiêu hợp chất ion trong dãy các chất sau: KBr, MgO, NH3, CaO, KCl, KOH?
Cho năng lượng liên kết H – H là 436 ![]() . Tính năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử
. Tính năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử ![]() , cho biết
, cho biết ![]() (Kết quả làm tròn đến hàng phần trăm)
(Kết quả làm tròn đến hàng phần trăm)
Cho số hiệu của nguyên tố N và O lần lượt là 7 và 8. Biết rằng hóa trị của nguyên tố N trong phân tử ![]() bằng tổng số liên kết σ và liên kết π mà nguyên tử N tạo thành khi liên kết với các nguyên tử xung quanh. Trong phân tử
bằng tổng số liên kết σ và liên kết π mà nguyên tử N tạo thành khi liên kết với các nguyên tử xung quanh. Trong phân tử ![]() , nguyên tử N không liên kết với nguyên tử H mà liên kết với 3 nguyên tử O. Từ đó viết được công thức Lewis phù hợp của phân tử HNO3 với hóa trị của N là n. Giá trị của n là bao nhiêu?
, nguyên tử N không liên kết với nguyên tử H mà liên kết với 3 nguyên tử O. Từ đó viết được công thức Lewis phù hợp của phân tử HNO3 với hóa trị của N là n. Giá trị của n là bao nhiêu?
Có bao nhiêu hợp chất tạo được liên kết hydrogen trong dãy các chất sau: ![]() , HF, HCl,
, HF, HCl, ![]() ?
?
Trong phản ứng ![]() các nguyên tử H đã góp bao nhiêu electron vào việc hình thành liên kết hóa học trong 1 phân tử nước?
các nguyên tử H đã góp bao nhiêu electron vào việc hình thành liên kết hóa học trong 1 phân tử nước?
Cho năng lượng của liên kết S – H ở điều kiện chuẩn là 368 kJ/mol. Năng lượng liên kết trong phân tử H2S bằng bao nhiêu kJ/mol?








