28 bài tập Bảng tuần hoàn các nguyên tố hóa học có đáp án
28 câu hỏi
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Nitrogen (N) thuộc nhóm VA trong bảng tuần hoàn các nguyên tố hóa học. Công thức của nitric acid (hydroxide tương ứng với oxide cao nhất của N) là
NO.
![]()
![]()
![]()
Cấu hình electron của nguyên tử sắt là ![]() Vị trí của sắt trong bảng tuần hoàn là
Vị trí của sắt trong bảng tuần hoàn là
ô số 26, chu kì 3, nhóm VIIIB.
ô số 26, chu kì 3, nhóm VIIIA.
ô số 26, chu kì 4, nhóm VIIIA.
ô số 26, chu kì 4, nhóm VIIIB.
Dãy nguyên tử nào sau đây có bán kính tăng dần?
F< S < Si < Ge < Ca < Rb.
Rb < Ca < Ge < Si <S<F.
F<Si<S<Ca<Ge < Rb.
F <Si < S<Ge<Ca < Rb.
Oxide nào dưới đây tác dụng với nước tạo ra môi trường acid?
CaO.
B. ![]() .
.
BaO.
D. ![]() .
.
Cho số hiệu nguyên tử của nguyên tố R là 7. Phát biểu nào sau đây sai?
Công thức oxide cao nhất của R là ![]() .
.
R có tính phi kim mạnh hơn Si (Z = 14).
R là nguyên tố p.
Nguyên tử R có 5 electron ở phân lớp ngoài cùng.
Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào sau đây?
Các nguyên tố hóa học được xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
Các nguyên tố có cùng số lớp electron trên nguyên tử được xếp thành một hàng.
Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Magnesium là nguyên tố có khối lượng riêng nhỏ hơn một phần ba so với nhôm. Magnesium giúp cải thiện các đặc tính cơ học của nhôm khi được sử dụng làm chất tạo hợp kim. Những hợp kim này rất hữu ích trong chế tạo máy bay và ô tô. Cấu hình electron của magnesium là ![]() Công thức hydroxide của magnesium là
Công thức hydroxide của magnesium là
Mg(OH).
B. ![]() .
.
MgO(OH).
D. ![]() .
.
Trong một chu kì của bảng tuần hoàn các nguyên tố hóa học, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử của các nguyên tố giảm dần do số lớp electron ... (I), lực hút giữa hạt nhân với electron lớp ngoài cùng...(II). Cụm từ cần điền vào (I), (II) lần lượt là
tăng dần, tăng dần.
giảm dần, giảm dần.
không đổi, tăng dần.
không đổi, giảm dần.
Phát biểu nào sau đây là đúng về xu hướng biển đổi tính kim loại trong bảng tuần hoàn các nguyên tố hoá học?
Tính kim loại của các nguyên tố tăng theo chiều từ trái sang phải trong một chu kì vàtừ trên xuống dưới trong một nhóm.
Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và tăng dần từ trên xuống dưới trong một nhóm.
Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và từ trên xuống dưới trong một nhóm.
Tính kim loại tăng dần theo chiều từ trái sang phải trong một chu kì và giảm dần từ trên xuống dưới trong một nhóm.
Biết số hiệu nguyên tử của 2 nguyên tố X và Y lần lượt là 19 và 17. Cho các phát biểu:
(a) Độ âm điện của nguyên tử X lớn hơn độ âm điện của nguyên tử Y.
(b) Số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y.
(c) Trong các phản ứng hóa học, nguyên tử X có xu hướng nhường 1 electron.
(d) Khi hình thành liên kết với nguyên tử X, nguyên tử Y nhận 1 electron.
Số phát biểu đúng là
2.
3.
1.
4.
Cho các nguyên tố sau: Li, Na, K, Ca. Nguyên tử của nguyên tố có bán kính lớn nhất là
Li.
Na.
K.
Ca.
Hydroxide nào có tính acid mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được dùng để phân hủy các quặng phức tạp; phân tích khoáng vật hoặc làm chất xúc tác.
Silicic acid.
Sulfuric acid.
Phosphoric acid.
Perchloric acid.
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ![]() Trong hợp chất khí của nguyên tố X với hydrogen, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxide cao nhất là
Trong hợp chất khí của nguyên tố X với hydrogen, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxide cao nhất là
40,00%.
27,27%.
60,00%.
50,00%.
Nguyên tố R có cấu hình electron: ![]() Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là
Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là
![]()
![]()
![]()
![]()
Nguyên tố silicon (Si) thuộc chu kì 3, nhóm IVA trong bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của silicon là
![]()
![]()
SiO.
![]()
Đối với các nguyên tố nhóm A trong bảng tuần hoàn các nguyên tố hóa học, trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính phi kim của nguyên tố
có xu hướng tăng dần.
có xu hướng giảm dần.
có xu hướng không đổi.
không dự đoán được xu hướng biến đổi.
Trong các chất dưới đây, chất nào có tính acid mạnh nhất?
![]()
![]()
![]()
![]()
Cation R+ có cấu hình electron ![]() Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
chu kì 4, nhóm IIA.
chu kì 3, nhóm VIIIA.
chu kì 4, nhóm IA.
chu kì 3, nhóm VIIA.
Phần 2. Trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d ở mỗi câu, học sinh chọn đúng hoặc sai.
Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20.
a. Kính bán nguyên tử tăng dần từ X < Y < Z.
b. Thứ tự giảm dần tính base là 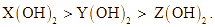
c. Các nguyên tố này đều là kim loại mạnh nhất trong chu kì.
d. X, Y, Z là các nguyên tố s và có cấu hình electron dạng ![]()
Oxide ứng với hóa trị cao nhất của một nguyên tố R có công thức thực nghiệm là R2O5. Oxide này là một chất hút nước mạnh, được sử dụng trong tổng hợp chất hữu cơ. Hợp chất khí của R với hydrogen có chứa 8,82% khối lượng hydrogen là chất khí không màu, rất độc, kém bền, sinh ra trong quá trình phân hủy xác động thực vật.
a. Tính phi kim của R mạnh hơn của nguyên tố S (sulfur).
b. Nguyên tố R thuộc ô số 15, chu kì 3, nhóm VA.
c. Khi cho 1 mol hydroxide ứng với hóa trị cao nhất của R tác dụng với dung dịch NaOH dư thì số mol NaOH phản ứng là 3.
d. Trong công thức oxide cao nhất của R thì R chiếm 34,66% về khối lượng.
Sulfur (S) là chất rắn, xốp, màu vàng ở điều kiện thường. Sulfur và hợp chất của nó được sử dụng trong acquy, bột giặt, thuốc diệt nấm; do dễ cháy nên S còn được dùng để sản xuất các loại diêm, thuốc súng, pháo hoa,….Sulfur là nguyên tố thuộc nhóm VIA, chu kì 3 trong bảng tuần hoàn.
a. Nguyên tử S có 2 lớp electron và có 6 electron lớp ngoài cùng.
b. Công thức oxide cao nhất của S có dạng SO3 và là acidic oxide.
c. Nguyên tố S có tính phi kim mạnh hơn nguyên tố O (Z = 8).
d. Hydroxide ứng với oxide cao nhất của S có dạng H2SO4 và có tính acid.
Natri (sodium, ![]() ) và magnesium (
) và magnesium (![]() ) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
a. Theo xu hướng biến đổi tính kim loại, Mg có tính kim loại mạnh hơn Na.
b. Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg.
c. Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
d. Khi phản ứng với ![]() , Na và Mg đều tạo ra hợp chất ion.
, Na và Mg đều tạo ra hợp chất ion.
Phần 3. Trắc nghiệm yêu cầu trả lời ngắn
Cho 6 nguyên tố có số hiệu nguyên từ lần lượt là 10, 13, 17, 18, 19 và 20. Trong số các nguyên tố trên có bao nhiêu nguyên tố kim loại?
Nguyên tố Y thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của Y là ![]() Khi cho 1 mol
Khi cho 1 mol ![]() tác dụng với dung dịch NaOH dư thì số mol NaOH phản ứng là bao nhiêu?
tác dụng với dung dịch NaOH dư thì số mol NaOH phản ứng là bao nhiêu?
Cho 6 gam hỗn hợp hai kim loại thuộc nhóm IIA ở hai chu kì liên tiếp tác dụng vừa đủ với dung dịch HCl thấy thoát ra 4,958 lít khí H2 (ở 25 oC và 1 bar). Xác định hai kim loại đó.
Nguyên tố Y thuộc chu kì 2, nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học. Nguyên tử của nguyên tố Y có số electron là bao nhiêu?
Nguyên tử nguyên tố X có số hiệu nguyên tử là 17. Phân tử hydroxide cao nhất của X là HaXbOc. Tổng hệ số (a + b + c) bằng bao nhiêu?
Một hợp chất có công thức ![]() trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Hợp chất này được sử dụng như chất trung gian để sản xuất sulfuric acid. Nguyên tố X trong hợp chất trên nằm ở chu kì mấy của bảng tuần hoàn?
trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Hợp chất này được sử dụng như chất trung gian để sản xuất sulfuric acid. Nguyên tố X trong hợp chất trên nằm ở chu kì mấy của bảng tuần hoàn?








