25 câu hỏi
Chọn đáp án đúng: Hoà tan 155 mg một bazơ hữu cơ đơn chức (M = 31) vào 50ml nước, dung dịch thu được có pH = 10. Tính độ phân li của base này (giả sử thể tích dung dịch không đổi khi pha loãng):
5%
1%
0,1%
0,5%
Chọn đáp án đúng: Hòa tan 1 mol KNO₃ vào 1 lít nước, nhiệt độ đông đặc của dung dịch thấp hơn nhiệt độ đông đặc của nước là 3,01°C ở cùng áp suất. Hằng số nghiệm đông của nước là 1,86 độ/mol. Vậy độ điện li biểu kiến của KNO₃ trong dung dịch trên là:
61,8%
52,0%
5,2%
6,2%
Chọn đáp số chính xác nhất. Trong dung dịch HF 0,1M ở 25°C có 8% HF bị ion hóa. Hỏi hằng số điện li của HF ở nhiệt độ này bằng bao nhiêu?
7,0.10⁻²
6,4.10⁻²
6,4.10⁻⁴
7,0.10⁻⁴
Chọn phương án đúng: Nhiệt độ sôi của dung dịch BaCl₂ có nồng độ molan Cm = 0,159 m là 100,208° C. Độ điện li biểu kiến của BaCl₂ trong dung dịch nước là: (cho hằng số nghiệm sôi của nước là 0,52)
2,5
1
0,76
Kết quả khác
Chọn phương án đúng: Hằng số cân bằng của phản ứng sau được tính theo công thức:2NaH₂PO₄(dd) + 3Ca(CH₃COO)₂(dd) ⇄ Ca₃(PO₄)₂(r) + 2NaCH₃COO(dd) + 4CH₃COOH(dd)
Kcb = 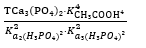
Kcb = 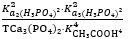
Kcb = 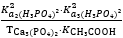
Kcb = 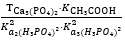
Chọn phương án đúng: Cho phản ứng trao đổi ion: Na₂Ni(CN)₄ + H₂S(dd) ⇄ NiS(r) + 2HCN(dd) + 2NaCN(dd). Hằng số không bền của ion phức [Ni(CN)₄]²⁻ bằng 1×10⁻³¹, tích số tan của NiS bằng 1×10⁻¹⁹, hằng số điện li acid của HCN bằng 1×10⁻⁹·²¹ và các hằng số điện li acid của H₂S lần lượt bằng 1×10⁻⁷·² và 1×10⁻¹⁴. Hằng số cân bằng của phản ứng trên bằng:
1×10¹⁴·⁷⁸
1×10⁻¹⁴·⁷⁸
1×10⁻⁰·⁷⁸
1×10⁰·⁷⁸
Chọn phương án đúng: Cho phản ứng trao đổi ion: NH₄Cl(dd) + Na₂S(dd) + H₂O → NH₄OH(dd) + NaHS(dd) + NaCl(dd).Biết hằng số điện li thứ hai của H₂S Ka₂ = 10⁻¹²·⁸⁹, hằng số điện li của NH₄OH Kb = 10⁻⁴·⁷⁶ và tích số ion của nước Kn = 10⁻¹⁴. Hằng số cân bằng của phản ứng trên bằng:
1×10⁻³·⁶⁵
1×10²²·¹³
1×10³·⁶⁵
Đáp số khác
Chọn các câu sai:
1) Chỉ các chất điện li mạnh mới cần sử dụng khái niệm hoạt độ (a) thay cho nồng độ trong biểu thức định luật tác dụng khối lượng.
2) Khi pha loãng dung dịch thì hệ số hoạt độ (f) tăng.
3) Các dung dịch chất điện li yếu luôn có hệ số hoạt độ (f) bằng 1.
1, 2, 3
1, 2
2, 3
1, 3
Chọn câu sai:
Nồng độ của ion trong dung dịch thường nhỏ hơn hoạt độ của nó.
Hoạt độ của chất là nồng độ biểu kiến của chất trong dung dịch.
Hoạt độ của ion phụ thuộc vào lực ion của dung dịch.
Hằng số điện li không phụ thuộc vào hoạt độ của chất điện li và ion.
Chọn phương án đúng: Cho 3 dung dịch nước BaCl₂, Na₂CO₃ và NaCl và nước nguyên chất. BaCO₃ tan nhiều hơn cả trong:
Dung dịch BaCl₂
Dung dịch NaCl
Dung dịch Na₂CO₃
H₂O
Tính áp suất thẩm thấu của dung dịch NaNO₃ 0,05 M ở 0°C, giả thiết muối phân ly hoàn toàn: (Cho R = 0,082 l.atm/mol.K)
2,238 atm
0,2238 atm
1,119 atm
0,1119 atm
Áp suất hơi bão hòa của dung dịch chứa 22,1 g CaCl₂ trong 100 g nước ở 20°C là 16,34 mmHg, áp suất hơi bão hòa của nước nguyên chất là 17,54 mmHg. Tính độ điện ly biểu kiến của CaCl₂:
32,42%
36,24%
48,87%
31,25%
Xác định áp suất hơi bão hòa của dung dịch hợp chất AB₂ ở 40°C, biết áp suất hơi bão hòa của nước ở nhiệt độ này là 34,1 mmHg, biết dung dịch có nhiệt độ đông đặc là -3,5°C, và AB₂ tạo hỗn hợp eutectic với nước
30,4 mmHg
32,1 mmHg
31,3 mmHg
Không đủ dữ kiện để tính
Chọn phát biểu đúng về hệ số Vant’ Hoff:
1) Hệ số Vant’ Hoff của các hợp chất bất kỳ luôn lớn hơn hoặc bằng 1.
2) Hệ số Vant’ Hoff của các hợp chất ion luôn lớn hơn 1.
3) Hệ số Vant’ Hoff của các hợp chất không phân ly bằng 1.
Chỉ 1, 3 đúng
Tất cả đều đúng
Chỉ 1, 2 đúng
Chỉ 2, 3 đúng
Chọn phát biểu đúng:
1) Hoạt độ biểu diễn nồng độ hiệu dụng của tiểu phân thể hiện trong các phản hóa học
2) Hệ số hoạt độ phản ánh tương tác giữa các ion.c
3) Hệ số hoạt độ chỉ phụ thuộc vào điện tích ion và lực ion của dung dịch.
4) Hoạt độ là đại lượng không có thứ nguyên.
1, 2, 4 đúng
3, 4 đúng
1, 2, 3 đúng
1, 2, 3, 4 đúng
Chọn phát biểu đúng:
1) Base liên hợp của một acid mạnh là một base yếu và ngược lại.
2) Đối với cặp acid-base liên hợp HPO₄²⁻/PO₄³⁻, trong dung môi nước ta có: Ka × Kb = Kn, trong đó Kn là tích số ion của nướ
3) Hằng số điện li Kb của NH₃ trong dung dịch nước là 1,8 × 10⁻⁵, suy ra Ka của NH₄⁺ là 5,62×10⁻¹⁰ C.
1
2
1, 2, 3
3
Chọn phát biểu đúng: Dựa vào ái lực proton của các dung môi NH₃ và HCl cho biết rượu thể hiện tính chất gì trong dung môi đó:
Tính bazơ trong cả 2 dung môi.
Tính bazơ trong HCl, tính acid trong NH₃.
Tính bazơ trong NH₃, tính acid trong HCl.
Tính acid trong cả 2 dung môi.
Chọn phát biểu đúng: Biết các hằng số acid trong dung dịch nước Ka (HCN) = 6,2×10⁻¹⁰; Ka (HNO₂) = 4×10⁻⁴. Trong số các base Bronsted CN⁻, OH⁻, NO₂⁻ base nào mạnh nhất trong dung dịch nước?
OH⁻
CN⁻
NO₂⁻
Không xác định được
Chọn phát biểu đúng:
1) Acid càng yếu thì pKa càng lớn.
2) Dung dịch một base yếu có pH càng nhỏ khi pKb của nó càng lớn.
3) Base càng mạnh khi pKb càng lớn
4) Giữa pKa và pKb của các dạng acid và base của H2PO4- có pKa + pKb = 14
2, 3
1, 2
1, 3, 4
1, 2, 4
Chọn phát biểu đúng và đầy đủ nhất. Các chất lưỡng tính theo thuyết proton (thuyết Bronsted) trong các chất sau: NH₄⁺, CO₃²⁻, HCO₃⁻, H₂O, CH₃COOH là:
CO₃²⁻, HCO₃⁻
HCO₃⁻, H₂O
NH₄⁺, H₂O
HCO₃⁻, H₂O, CH₃COOH
Chọn đáp án đúng:Cho các chất sau: CH₃COOH, H₂PO₄⁻, NH₄⁺, theo thuyết proton, các cặp acid - base liên hợp xuất phát từ chúng là:
CH₃COOH₂⁺/CH₃COOH; CH₃COOH/CH₃COO⁻; H₃PO₄/H₂PO₄⁻; H₂PO₄⁻/PO₄³⁻; NH₄⁺/NH₃
CH₃COOH₂⁺/CH₃COO⁻; CH₃COOH/CH₃COO⁻; H₃PO₄/H₂PO₄⁻; H₂PO₄⁻/HPO₄²⁻; NH₄⁺/NH₃
CH₃COOH₂⁺/CH₃COOH; CH₃COOH/CH₃COO⁻; H₃PO₄/H₂PO₄⁻; H₂PO₄⁻/HPO₄²⁻; NH₄⁺/NH₃
CH₃COOH₂⁺/CH₃COOH; CH₃COOH/CH₃COO⁻; H₃PO₄/H₂PO₄⁻; H₂PO₄⁻/HPO₄²⁻; NH₅²⁺/NH₃
Chọn trường hợp đúng và đầy đủ nhất. Theo thuyết proton (thuyết Bronsted) trong các chất sau: Na⁺, Mn²⁺, Fe²⁺(dd), NH₄⁺, CO₃²⁻, HCO₃⁻, H₂O, HCl
Các chất lưỡng tính: HCO₃⁻, H₂OCác chất trung tính: Na⁺, Mn²⁺, Fe²⁺
Các chất lưỡng tính: NH₄⁺, H₂O, HClCác chất trung tính: Na⁺, Mn²⁺, Fe²⁺
Các chất lưỡng tính: HCO₃⁻, H₂OCác chất trung tính: Na⁺, Mn²⁺
Các chất lưỡng tính: HCO₃⁻, H₂O, HClCác chất trung tính: Na⁺, Mn²⁺
Chọn phương án đúng: Khi hòa tan H₃PO₄ vào nước, trong dung dịch sẽ tồn tại các ion và tiểu phân H₃PO₄, H⁺, HPO₄²⁻, H₂PO₄⁻, PO₄³⁻. Các tiểu phân này được sắp xếp theo thứ tự nồng độ tăng dần như sau:
H₃PO₄ < H⁺ < PO₄³⁻ < HPO₄²⁻ < H₂PO₄⁻
H₃PO₄ < H⁺ < H₂PO₄⁻ < HPO₄²⁻ < PO₄³⁻
PO₄³⁻ < HPO₄²⁻ < H₂PO₄⁻ < H⁺ < H₃PO₄
H⁺ < H₂PO₄⁻ < HPO₄²⁻ < PO₄³⁻ < H₃PO₄
Chọn phương án đúng: Số lượng ion H⁺ chứa trong 1 lít dung dịch có pOH = 13 là:
6,023×10¹⁰
6,023×10²²
6,023×10²³
6,023×10¹³
Chọn phương án đúng: Sắp các dung dịch có cùng nồng độ mol của các chất sau đây theo thứ tự pH tăng dần: H₂SO₄, H₃PO₄, HClO₄, NaHCO₃
H₂SO₄ < HClO₄ < H₃PO₄ < NaHCO₃
NaHCO₃ < H₃PO₄ < HClO₄ = H₂SO₄
H₂SO₄ = HClO₄ < H₃PO₄ < NaHCO₃
H₃PO₄ < H₂SO₄ < HClO₄ < NaHCO₃
