28 bài tập Năng lượng hoá học có đáp án
28 câu hỏi
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Cho phương trình nhiệt hóa học của phản ứng:
CO2(g) ® CO(g) + ![]() O2(g);
O2(g); ![]() = + 280 kJ
= + 280 kJ
Lượng nhiệt cần cung cấp để tạo thành 56 g CO(g) là
140 kJ.
560 kJ.
–140 kJ.
–560 kJ.
Phản ứng nào sau đây là phản ứng toả nhiệt?
Phản ứng nhiệt phân muối KNO3.
Phản ứng phân huỷ khí NH3.
Phản ứng oxi hoá glucose trong cơ thể.
Phản ứng hoà tan ![]() trong nước.
trong nước.
Cho hai phương trình nhiệt hóa học sau:
![]()
![]() = +131,25 kJ (1)
= +131,25 kJ (1)
![]()
![]() = −231,04 kJ (2)
= −231,04 kJ (2)
Trong hai phản ứng trên, phản ứng nào là thu nhiệt, phản ứng nào là tỏa nhiệt?
Phản ứng (1) tỏa nhiệt và phản ứng (2) thu nhiệt.
Cả 2 phản ứng đều tỏa nhiệt.
Cả 2 phản ứng đều thu nhiệt.
Phản ứng (1) thu nhiệt và phản ứng (2) tỏa nhiệt.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
2C (than chì)![]()
C (than chì) + ![]()
C (than chì)![]()
C (than chì)![]()
Cho enthalpy tạo thành chuẩn của một số chất như sau:
Chất | TiCl4(g) | H2O(l) | TiO2(s) | HCl(g) |
| -763 | -286 | -945 | -92 |
Biến thiên enthalpy chuẩn của phản ứng ![]() là
là
+3 kJ.
+22 kJ.
−22 kJ.
−3229 kJ.
Calcium oxide (CaO) đã phản với nước trong một cốc chịu nhiệt theo phương trình:
![]()
Ghi nhận giá trị nhiệt độ sau khoảng 2 phút thấy nhiệt độ chất lỏng trong cốc tăng lên từ ![]() đến
đến ![]() Kết luận nào sau đây là đúng?
Kết luận nào sau đây là đúng?
Phản ứng trên là phản ứng thu nhiệt.
Phản ứng trên có giá trị
Phản ứng có năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm.
Phản ứng trên giải phóng năng lượng dưới dạng nhiệt.
Cho các phương trình nhiệt hóa học:
(1) ![]()
![]() = +176,0 kJ.
= +176,0 kJ.
(2) ![]()
![]() = −137,0 kJ.
= −137,0 kJ.
(3) ![]()
![]() = −851,5 kJ.
= −851,5 kJ.
Trong các phản ứng trên, phản ứng tỏa nhiệt là
(1), (3).
(2), (3).
(2).
(1).
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết là
![]() (cđ)
(cđ) ![]() .
.
![]() (cđ)
(cđ) ![]() .
.
(sp) ![]() (cđ).
(cđ).
(cđ) ![]() (sp).
(sp).
Phát biểu nào sau đây đúng về điều kiện chuẩn?
Là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ ![]() (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K.
(đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K.
Là điều kiện ứng với nhiệt độ 298K và áp suất 1 atm.
Là điều kiện ứng với 760 mmHg.
Là điều kiện ứng với áp suất 1 atm và nhiệt độ 0oC (273K).
Năng lượng liên kết Cl – Cl là 243 kJ ![]() của H – H là 436
của H – H là 436 ![]() Cho biết enthalpy tạo thành chuẩn của HCl là − 91
Cho biết enthalpy tạo thành chuẩn của HCl là − 91 ![]() Năng lượng liên kết của H – Cl là
Năng lượng liên kết của H – Cl là
430,5 ![]()
290,0 ![]()
490,0 ![]()
245,0 ![]()
Cho phản ứng:
![]()
Phát biểu nào dưới đây là không đúng?
Biến thiên enthalpy chuẩn của phản ứng là ![]() .
.
Nhiệt tạo thành chuẩn của ![]() là
là ![]() .
.
Phản ứng là phản ứng tỏa nhiệt.
Phản ứng làm nóng môi trường xung quanh.
Enthalpy tạo thành chuẩn của một chất (![]() là lượng nhiệt kèm theo của phản ứng tạo thành:
là lượng nhiệt kèm theo của phản ứng tạo thành:
1 gam chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
1 gam chất đó từ các đơn chất ở dạng bền nhất trong điều kiện tiêu chuẩn.
1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện tiêu chuẩn.
Enthalpy tạo thành chuẩn của các khí ![]() và HI lần lượt là 142,2
và HI lần lượt là 142,2 ![]() ;
; ![]() ; −45,9
; −45,9 ![]() và 26,5
và 26,5 ![]() . Dãy có độ bền tăng dần của các hợp chất trên là
. Dãy có độ bền tăng dần của các hợp chất trên là
![]()
![]()
![]()
![]()
Enthalpy tạo thành chuẩn (nhiệt tạo thành ở điều kiện chuẩn) có kí hiệu là
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Khí thiên nhiên chứa chủ yếu các thành phần chính: methane (![]() ), ethane (
), ethane (![]() ) và một số thành phần khác. Cho các phương trình nhiệt hóa học sau:
) và một số thành phần khác. Cho các phương trình nhiệt hóa học sau:
![]()
![]()
Giả sử, một hộ gia đình cần 10 000kJ nhiệt mỗi ngày, sau bao nhiêu ngày sẽ dùng hết bình gas 13 kg khí thiên nhiên với tỉ lệ thể tích của methane : ethane là 85 : 15 (thành phần khác không đáng kể) với hiệu suất hấp thụ nhiệt khoảng 65%)
46 ngày.
43 ngày.
53 ngày.
55 ngày.
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Liên kết | C–H | C–C | C=C |
Eb (kJ mol – 1 ) | 418 | 346 | 612 |
Biến thiên enthalpy chuẩn của phản ứng: ![]() có giá trị là
có giá trị là
+103 kJ.
–103 kJ.
+80 kJ
–80 kJ.
Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là ![]() kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
0,450 kJ.
![]() kJ.
kJ.
![]() kJ.
kJ.
![]() kJ.
kJ.
Dung dịch glucose (C6H12O6) 5%, có khối lượng riêng là 1,02 g/mL, phản ứng oxi hóa 1 mol glucose tạo thành ![]() (g) và
(g) và ![]() (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai nước chứa 500 mL dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
(l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai nước chứa 500 mL dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
+397,09 kJ.
-397,09 kJ.
+416,02 kJ.
-416,02 kJ.
Phần 2. Trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d ở mỗi câu, học sinh chọn đúng hoặc sai.
Cho hai phương trình nhiệt hóa học sau:
(1) ![]()
![]()
(2) ![]()
![]()
![]()
a. Khi đốt cháy cùng 1 mol CO và ![]() thì phản ứng (2) tỏa ra lượng nhiệt lớn hơn phản ứng (1).
thì phản ứng (2) tỏa ra lượng nhiệt lớn hơn phản ứng (1).
b. Phương trình (1) là phương trình nhiệt tạo thành CO2(g).
c. Trong phản ứng (1) thì 1 mol ![]() nhận 2 mol electron.
nhận 2 mol electron.
d. Đốt cháy 0,5 kg cồn ![]() thì tỏa ra nhiệt lượng là 14 857,5 kJ
thì tỏa ra nhiệt lượng là 14 857,5 kJ
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hoá học sau:
![]()
a. Biến thiên enthalpy chuẩn của phản ứng là 483,64 kJ.
b. Khi tạo thành 27 gam nước (gas) thì phản ứng đã cung cấp cho môi trường một lượng nhiệt là 725,46kJ.
c. Tổng năng lượng của hỗn hợp 1 mol oxygen (gas) và 2 mol hydrogen (gas) có năng lượng lớn hơn năng lượng của 2 mol nước (hơi).
d. Enthalpy tạo thành chuẩn của H2O(g) là -241,82 kJ/mol.
Cho sơ đồ sau:
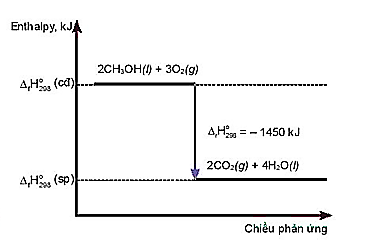
a. Phương trình nhiệt hoá học của phản ứng là: 2CH3OH(l) + 3O2(g) → 2CO2(g) + 4H2O(l).
b. Công thức tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành là:
![]()
![]()
c. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
d. Sau phản ứng, sản phẩm có mức năng lượng cao hơn chất ban đầu.
Cho các phản ứng hóa học sau đây (ở điều kiện chuẩn):
(1) ![]()
![]()
(2) ![]()
![]()
(3) ![]()
![]()
a. Phản ứng (2) là phản ứng thu nhiệt.
b. Các phản ứng (1) và (3) là phản ứng tỏa nhiệt.
c. Nhiệt tạo thành chuẩn của ![]() là -571,6
là -571,6 ![]()
d. Về mặt năng lượng, phản ứng (3) thuận lợi hơn phản ứng (1) và (2).
Phần 3. Trắc nghiệm yêu cầu trả lời ngắn
Cho phản ứng sau: ![]() . Biết nhiệt tạo thành chuẩn của
. Biết nhiệt tạo thành chuẩn của ![]() lần lượt là
lần lượt là![]() Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu?
Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu?
Xét quá trình đốt cháy khí propane ![]() (g):
(g):
![]() (g) + 5
(g) + 5![]() (g)
(g) ![]() 3
3![]() (g) + 4
(g) + 4![]() (g)
(g)
Biết:
Chất |
|
|
|
| –105,00 | –393,50 | –241,82 |
Tính thể tích khí ![]() (g) (Lít ở đkc) cần đốt cháy hoàn toàn để đun sôi 1 ấm nước (biết để đun sôi 1 ấm nước cần nhiệt lượng là 66kJ; nhiệt lượng bị thất thoát ra môi trường là 25%). (Kết quả làm tròn đến hàng phần trăm)
(g) (Lít ở đkc) cần đốt cháy hoàn toàn để đun sôi 1 ấm nước (biết để đun sôi 1 ấm nước cần nhiệt lượng là 66kJ; nhiệt lượng bị thất thoát ra môi trường là 25%). (Kết quả làm tròn đến hàng phần trăm)
Trong ngành công nghệ lọc hóa dầu, các alkane thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tạo ra những sản phẩm hydrocarbon không no có nhiều ứng dụng trong công nghiệp.
Dựa vào năng lượng liên kết, tính biến thiên enthalpy chuẩn của các phản ứng:
H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
Cho biết:
Liên kết | Eb (kJ/mol) | Liên kết | Eb (kJ/mol) |
C=C | 611 | H–H | 436 |
C–H | 414 | C-C | 347 |
Một người thợ xây trong buổi sáng kéo được 500 kg vật liệu xây dựng lên tầng cao 10m. Để bù vào năng lượng đã tiêu hao, người đó cần uống cốc nước hòa tan m gam glucose. Biết nhiệt tạo thành của glucose (![]() ),
), ![]() và
và ![]() lần lượt là -1271, -393,5 và -285,8 kJ/mol. Giá trị của m bằng bao nhiêu?
lần lượt là -1271, -393,5 và -285,8 kJ/mol. Giá trị của m bằng bao nhiêu?
Ngày nay, dùng cồn khô trong nấu ăn trở nên rất phổ biến trong các nhà hàng, quán ăn, buổi tổ chức tiệc, liên hoan, hộ gia đình. Một mẫu cồn X chứa thành phần chính là ethanol ![]() có lẫn methanol (
có lẫn methanol (![]() ). Cho các phương trình nhiệt hóa học sau:
). Cho các phương trình nhiệt hóa học sau:
![]()
![]()
![]()
![]()
Biết thành phần 1 viên cồn 70 gam chứa tỉ lệ khối lượng của ![]() là 11:1 và chứa 4% tạp chất không cháy. Giả sử để nấu chín một nồi lẩu cần tiêu thụ 3200 kJ, hỏi cần bao nhiêu viên cồn để nấu chín 1 nồi lẩu đó (với hiệu suất hấp thụ nhiệt khoảng 80%)?
là 11:1 và chứa 4% tạp chất không cháy. Giả sử để nấu chín một nồi lẩu cần tiêu thụ 3200 kJ, hỏi cần bao nhiêu viên cồn để nấu chín 1 nồi lẩu đó (với hiệu suất hấp thụ nhiệt khoảng 80%)?
Nitrogen trifluoride (![]() là nguyên liệu được sử dụng trong việc sản xuất pin mặt trời. Phương trình hình thành nitrogen trifluoride được biểu diễn như sau:
là nguyên liệu được sử dụng trong việc sản xuất pin mặt trời. Phương trình hình thành nitrogen trifluoride được biểu diễn như sau:
![]()
Cho năng lượng liên kết của các loại liên kết như sau:
Loại liên kết | Năng lượng liên kết (kJ/mol) |
| + 950 |
F – F | + 150 |
N – F | + 280 |
Giá trị biến thiên enthalpy chuẩn của phản ứng là bao nhiêu (kJ)?








