Bộ 5 đề thi giữa kì Hóa 10 Chân trời sáng tạo (2023-2024) có đáp án - Đề 5
31 câu hỏi
Các đồng vị thuộc loại nguyên tố hoá học có cùng đặc điểm nào sau đây?
Cùng số hạt neutron.
Cùng số khối.
Cùng số hạt proton.
Cùng khối lượng.
Các nguyên tố Li, K, Na, Rb được xếp vào nhóm IA trong bảng tuần hoàn là do chúng cùng
Số lớp electron.
Số phân lớp electron.
Số neutron.
Số electron hoá trị.
Trong nguyên tử, kích thước của nguyên tử chủ yếu là kích thước của
hạt nhân.
hạt proton.
hạt neutron.
lớp vỏ electron.
Kí hiệu nguyên tử cho biết những điều gì về nguyên tố X?
Nguyên tử khối trung bình của nguyên tử.
Tính chất vật lí của X.
Số hiệu nguyên tử và số khối.
Tính chất hoá học của X.
Hình dạng nào sau đây là của orbital s?
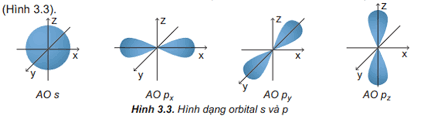
Hình (4).
Hình (3).
Hình (1).
Hình (2).
Lớp M có số orbital tối đa bằng:
9.
18.
4
3
Orbital nguyên tử AO là
khu vực không gian xung quanh hạt nhân có thể tìm thấy electron.
khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 90%.
khu vực không gian xung quanh hạt nhân ít tìm thấy electron.
khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 45%.
Kí hiệu phân lớp electron nào sau đây không đúng?
2p
3p
1d
3d
Phát biểu nào sau đây là đúng khi nói về mô hình Rutherford – Bohr?
Electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo xác định.
Electron ở càng xa hạt nhân thì có năng lượng càng thấp.
Electron chuyển động trên những quỹ đạo hình tròn hay hình bầu dục xác định xung quanh hạt nhân
Electron chịu lực hút của hạt nhân nên không chuyển động mà đứng im.
Trong các hiện tượng sau, hiện tượng hoá học là:
hoá lỏng không khí để tách lấy nitrogen.
chẻ củi.
đường kính nghiền thành bột.
thức ăn bị ôi thiu.
Ở trạng thái cơ bản, cấu hình electron nguyên tử chlorine (Z = 17) có bao nhiên phân lớp?
5
3
2
1.
Nguyên tử nguyên tố nào sau đây có hạt neutron lớn nhất?
Trong bảng tuần hoàn các nguyên tố hoá học, các nguyên tố được sắp xếp thành một hàng, gọi là
nhóm
chu kỳ.
ô nguyên tố.
số hiệu nguyên tử.
Nguyên tử oxygen (O) có 8 electron. Điện tích hạt nhân nguyên tử oxygen là
+8
-16.
+16
-8
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hoá học?
Thành phần, cấu trúc của chất.
Sự ra đời và phát triển của nền văn minh lúa nước.
Sự tự quay của trái đất quanh trục riêng.
Sự vận chuyển của máu trong hệ tuần hoàn.
Sự chuyển động của electron theo mô hình hiện đại được mô tả:
eletron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
electron chuyển động từ từ xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
eletron chuyển động rất chậm xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
eletron chuyển động rất nhanh xung quanh hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
Năm 1869, nhà hoá học và giáo viên người Nga đã công bố bảng tuần hoàn các nguyên tố hoá học. Nhà hoá học và giáo viên được nhắc đến là
Newland
Dobreiner
Mendeleev
Meyer.
Biểu thức nào sau đây không đúng?
Số khối (A) = Số proton (P) + Số neutron (N)
Số khối (A) = Số proton (P) - Số neutron (N)
Số electron (E) = Số proton (P)
Số proton (P) = Số khối (A) - Số neutron (N)
Trong nguyên tử, loại hạt nào có khối lượng nhỏ nhất so với các hạt còn lại?
Electron
Proton
Neutron
Neutron và electron.
Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 neutron. Kí hiệu của nguyên tử nguyên tố A là:
X và Y là những nguyên tử thuộc một loại nguyên tố hoá học. Vậy X và Y có cùng
Khối lượng
Số proton
Số khối
số neutron.
Nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
O (Z=8)
Cl (Z=17)
Al (Z=13)
Si (Z=14)
Lớp electron thứ 3 có bao nhiêu phân lớp?
4
1
2
3.
Phân lớp d có số orbital bằng
7
1
5
3.
Cấu hình electron nào của nguyên tử X có 3 lớp electron và 2 electron độc thân?
1s22s22p63s23p3
1s22s22p63s23p5
1s22s22p63s23p4
1s22s22p63s23p1
Nhóm các nguyên tố p là
Oxygen (Z=8) và Sodium (Z=11).
Carbon (Z=6) và Chlorine (Z=17).
Silicon (Z=14) và Iron (Z=26).
Hydrogen (Z=1) và Aluminium (Z=13).
Mỗi orbital nguyên tử (AO) chứa tối đa.
4 electron.
3 electron.
2 electron.
1 electron.
Hạt mang điện âm trong nguyên tử là hạt
electron.
neutron
hạt nhân,
proton.
(1,0 điểm) Aluminium (nhôm, Al) là kim loại phổ biến nhất trên vỏ Trái Đất, được sử dụng trong các ngành xây dựng, ngành điện hoặc sản xuất đồ gia dụng. Hạt nhân của nguyên tử aluminium có điện tích bằng +13 và số khối là 27.
(a) Tính số proton, số neutron và số electron có trong nguyên tử aluminium.
(b) Viết kí hiệu nguyên tử của nguyên tố aluminium.
(1,0 điểm) Cho nguyên tử các nguyên tố: X (Z = 13); Y (Z = 15).
(a) Viết cấu hình electron nguyên tử của các nguyên tố X và Y.
(b) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
(c) Biểu diễn cấu hình electron theo ô orbital, xác định số electron độc thân của nguyên tử X và Y.
(1,0 điểm) Nguyên tử của nguyên tố X có 7 electron ở các phân lớp s.
(a) Xác định các nguyên tố X và viết cấu hình electron (đầy đủ, thu gọn) của các nguyên tử X.
(b) Xác định số electron hoá trị của các nguyên tử X trên.








