Bộ 3 đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo có đáp án - Đề 3
31 câu hỏi
Những loại hạt cấu tạo nên hầu hết các nguyên tử là
Electron và neutron.
Electron và proton.
Neutron và proton.
Electron, neutron và proton.
Trong nguyên tử, hạt mang điện tích âm là
electron.
proton.
neutron.
proton và neutron
Hạt nhân của nguyên tử nào có số hạt neutron là 28?
.
.
.
.
Tổng số hạt proton, neutron và electron trong là
19.
28.
30.
32.
Nguyên tố hóa học là tập hợp các nguyên tử có cùng
số khối.
số proton.
số electron.
neutron.
Cho hai kí hiệu và . Phát biểu nào sau đây là đúng?
X và Y cùng thuộc về một nguyên tố hóa học.
X và Y là đồng vị của nhau.
X và Y cùng có 25 electron.
Hạt nhân của X và Y cùng có 25 hạt (proton và neutron).
Orbital s có dạng
hình tròn.
hình số 8 nổi.
hình cầu.
hình bầu dục.
Kí hiệu của orbital chứa 2 electron là
 .
.
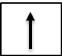 .
.
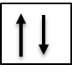 .
.
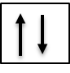 .
.
Lớp M có số orbital tối đa bằng
3.
4.
9.
18.
Phân lớp 4f có số electron tối đa là
6.
18.
10.
14
Cấu hình e của sulfur (Z = 16) là
1s2 2s2 2p6 3s1.
1s2 2s2 2p103s2.
1s2 2s2 2p6 3s2 3p4 3d10.
1s2 2s2 2p6 3s2 3p4.
Cấu hình electron nào sau đây thuộc về nguyên tố khí hiếm?
1s22s22p63s23p1.
1s22s22p63s23p3.
1s22s22p63s23p6.
1s22s22p63s23p4.
Electron thuộc lớp nào sau đây gần hạt nhân nhất?
Lớp N.
Lớp L.
Lớp M.
Lớp K.
Phân lớp nào sau đây bán bão hòa?
4s2.
4p6.
4d5.
4f4.
Nguyên tử M có cấu hình electron ở lớp ngoài cùng là 3s23p3. Nguyên tử M là
11Na.
18Ar.
17Cl.
15P.
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ tự năng lượng tăng dần là
s, d, p, f.
s, p, d, f
s, p, f, d
d, p, s.
Nguyên tử fluorine có 9 proton, 9 electron và 10 neutron. Số khối của nguyên tử fluorine là
9.
10.
19.
28.
Khối lượng của nguyên tử magnesium là 39,8271.10-27 kg. Khối lượng của magnesium theo amu là
23,985.
66,133.10-51.
24,000.
23,985.10-5.
Nguyên tử calcium có kí hiệu là Phát biểu nào sau đây sai?
Nguyên tử Ca có 20 electron.
Số hiệu nguyên tử của Ca là 20.
Nguyên tử Ca có 20 neutron.
Tổng số hạt cơ bản của calcium là 40.
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hoá học?
, , .
, , .
, , .
, , .
Biết trong tự nhiên carbon có 2 đồng vị và , oxygen có 3 đồng vị . Số loại phân tử CO tối đa có thể tạo thành là
2.
6.
9.
12.
Chu kì 3 của bảng hệ thống tuần hoàn có
2 nguyên tố.
8 nguyên tố.
10 nguyên tố.
18 nguyên tố.
Nguyên tố X có cấu hình electron 1s22s22p63s23p64s1 thuộc
ô 19, chu kì 4, nhóm IA.
ô 19, chu kì 4, nhóm IB.
ô 19, chu kì 3, nhóm IVA.
ô 19, chu kì 3, nhóm IA.
Trong bảng tuần hoàn, nguyên tố chlorine (kí hiệu: Cl) nằm ở chu kì 3, nhóm VIIA. Cấu hình electron của Cl là
1s22s22p5.
1s22s22p63s23p5.
1s22s22p63s2.
1s22s22p63s23p3.
Thông tin nào sau đây không đúng về ?
Số hiệu nguyên tử bằng 82.
Điện tích hạt nhân bằng 82.
Số neutron bằng 124.
Số khối bằng 206.
Trong nguyên tử tổng số hạt mang điện là
13 hạt.
14 hạt.
26 hạt.
40 hạt.
Nguyên tử của nguyên tố X có lớp ngoài cùng là lớp M, trên lớp M chứa 2 electron. Cấu hình electron của X và tính chất của X là
1s22s22p63s2, kim loại.
1s22s22p63s23p2, phi kim.
1s22s22p63s23p6, khí hiếm.
1s22s22p63s2, phi kim.
Các electron của nguyên tử X được phân bố trên 3 lớp, lớp thứ 3 có 4 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
6.
8.
14.
16.
(1 điểm): Phổ khối của bạc (silver, Ag) được biểu diễn như sau:
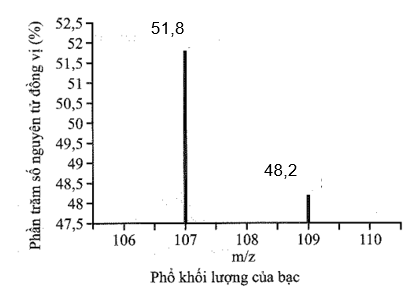
Tính nguyên tử khối trung bình của Ag.
(1 điểm): Cho nguyên tử của nguyên tố X số hiệu nguyên tử là 12.
(a) Viết cấu hình electron nguyên tử của X.
(b) Hãy cho biết nguyên tử của các nguyên tố trên là kim loại, phi kim hay khí hiếm.Vì sao?
(c) Biểu diễn cấu hình electron lớp ngoài cùng trên obital, xác định số electron độc thân của X.
(d) Nguyên tử Y có số electron ở các phân lớp p nhiều hơn số electron các phân lớp p của X là 3 electron. Xác định cấu hình electron của Y.
(1 điểm): Hợp chất ion XY có số electron của anion bằng số electron của cation và tổng số electron của XY là 20. Biết trong mọi hợp chất, Y chỉ có một hoá trị duy nhất.
Viết cấu hình electron của X, Y và xác định vị trí của chúng trong bảng tuần hoàn.








