Bộ 3 đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
electron và neutron.
proton và neutron.
neutron và electron.
electron, proton và neutron.
Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
proton.
neutron.
electron.
neutron và electron.
Nguyên tử aluminium có 13 proton và 14 neutron. Số hạt mang điện có trong nguyên tử này là
13.
14.
27.
26.
Phát biểu nào sau đây là đúng khi nói về nguyên tử?
Trong nguyên tử, số hạt proton luôn bằng số hạt neutron.
Điện tích của một nguyên tử có thể có giá trị âm, dương hoặc bằng 0.
Khối lượng của một nguyên tử (tính theo amu) luôn là số nguyên.
Lớp vỏ nguyên tử tạo nên bởi các electron.
Nguyên tử carbon có điện tích hạt nhân là +6. Số electron của nguyên tử này là
6.
12.
18.
24.
Số hạt electron của nguyên tử có kí kiệu \({}_{15}^{31}P\)là
31.
16.
15.
30.
Cho các nguyên tử sau: \[_{17}^{35}A;{}_9^{17}B;{}_8^{17}C;{}_{17}^{37}D\]. Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
A và B.
B và \[C.\]
C và D.
A và D.
Nguyên tử carbon có hai đồng vị bền: \[_6^{12}C\] chiếm 98,89% và \[_6^{13}C\] chiếm 1,11%. Nguyên tử khối trung bình của carbon là
12,50.
12,02.
12,01.
12,06.
Một nguyên tử được đặc trưng cơ bản bằng
Số proton và điện tích hạt nhân.
Số proton và số electron.
Số khối và số neutron.
Số khối và điện tích hạt nhân.
Sự phân bố electron theo ô orbital nào dưới đây là đúng?

B. 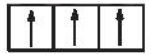
C. 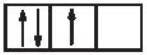
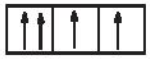
Số electron tối đa trong phân lớp d là
2
10
6
14
Cấu hình electron của nguyên tử nitrogen (Z = 7) là
1s12s12p5.
1s22s22p4.
1s22s22p3.
1s22s32p4.
Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
Kí hiệu nguyên tố.
Tên nguyên tố.
Số hiệu nguyên tử.
Số khối của hạt nhân.
Chu kì 4 của bảng tuần hoàn có số nguyên tố là
2 nguyên tố.
18 nguyên tố.
32 nguyên tố.
8 nguyên tố.
Bảng tuần hoàn hiện nay có số cột, số nhóm A và số nhóm B lần lượt là
18, 8, 8.
18, 8, 10.
18, 10, 8.
16, 8, 8.
Nguyên tử X có cấu hình electron [Ne]3s23p1. Vị trí của X trong bảng hệ thống tuần hoàn là
số thứ tự 3, chu kì 3, nhóm IIIA.
số thứ tự 11, chu kì 3, nhóm IIIA.
số thứ tự 13, chu kì 2, nhóm IA.
số thứ tự 13, chu kì 3, nhóm IIIA.
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là 3s2. Số thứ tự ô nguyên tố X trong bảng tuần hoàn là
12.
13.
11.
14.
Nguyên tố hóa học calcium (kí hiệu Ca) có số hiệu nguyên tử là 20, thuộc chu kì 4, nhóm IIA. Phát biểu nào sau đây về calcium là sai?
Số electron ở vỏ nguyên tử của nguyên tố đó là 20.
Vỏ của nguyên tử có 4 lớp electron và lớp ngoài cùng có 2 electron.
Hạt nhân của calcium có 20 proton.
Nguyên tố hóa học này là một phi kim.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện.
a. Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân.
b. Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
c. Số khối là khối lượng tuyệt đối của nguyên tử.
d. Trong nguyên tử, số hiệu nguyên tử bằng số proton.
Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp.
a. Thứ tự điền electron theo đúng thứ tự các lớp electron trong nguyên tử.
b. Electron được điền đầy hết lớp bên trong rồi mới tới những lớp bên ngoài.
c. Số lượng electron tối đa có thể điền vào mỗi phân lớp là 2.
d. Mỗi orbital nguyên tử chỉ điền được tối đa 2 electron.
Cho ba nguyên tử: \[_{29}^{63}X\], \[_{29}^{65}Y\]và \[_{30}^{65}Z\].
a. Z và Y là đồng vị của cùng một nguyên tố hóa học.
b. X và Y có cùng số khối.
c. X và Y là đồng vị của cùng một nguyên tố hóa học
d. X và Z có cùng số neutron.
Cấu hình electron nguyên tử của sulfur và selenium lần lượt là \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^4}\) và \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^4}.\)
a. S và Se nằm cùng một nhóm VIB.
b. Số electron lớp ngoài cùng của Se nhiều hơn S.
c. S và Se nằm ở hai chu kì kế tiếp nhau.
d. S là nguyên tố nhóm A, Se là nguyên tố nhóm B.
Phần III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Nguyên tố X có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố X điền vào lớp, phân lớp nào sau đây?
Cho phổ khối của nguyên tố R như sau:
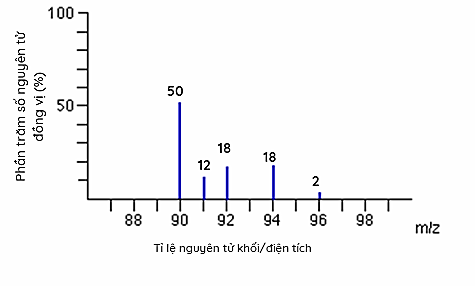
Nguyên tử khối trung bình của nguyên tố R là
Nguyên tử của nguyên tố A có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố B có một electron ở lớp ngoài cùng 4s. Nguyên tử A và B có số electron hơn kém nhau là 3. Tổng số hạt mang điện có trong A và B là?
Cấu hình electron nguyên tử của bromine là \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^5}.\) Vị trí của bromine trong bảng tuần hoàn là?
D. I. Mendeleev đã sắp xếp các nguyên tố hoá học vào bảng theo chiều tăng dần của đại lượng nào?
Hai nguyên tố A, B (ZB > ZA) đứng liên tiếp nhau trong một chu kì của bảng tuần hoàn, có tổng số đơn vị điện tích hạt nhân là 17. Xác định nguyên tố A, B.








