Bộ 5 đề thi giữa kì Hóa 10 Chân trời sáng tạo (2023-2024) có đáp án - Đề 1
31 câu hỏi
Số orbital trong phân lớp p bằng
3.
5.
1.
7.
Nguyên tử chứa những hạt mang điện là
proton và neutron.
electron.
electron và neutron.
proton và electron.
Điện tích hạt nhân của nguyên tử sulfur có 16 electron là
+17.
+16.
+15.
16.
Số electron ở lớp ngoài cùng của nguyên tử một nguyên tố hóa học bằng
số lớp electron trong nguyên tử.
số thứ tự của chu kì.
số thứ tự của nhóm các nguyên tố nhóm A.
số thứ tự của ô nguyên tố.
Trong các quá trình sau, quá trình nào xảy ra hiện tượng hoá học?
Pha nước đường.
Đun sôi nước.
Băng tuyết tan.
Đốt rơm rạ.
Những loại hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
Electron và proton.
Neutron và proton.
Electron, neutron và proton.
Electron và neutron.
Kí hiệu nguyên tử nào sau đây được viết đúng?
.
.
.
.
Kí hiệu chung của mọi nguyên tử là , trong đó Z là
kí hiệu nguyên tố.
số hiệu nguyên tử.
số khối.
khối lượng nguyên tử.
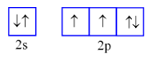
Nguyên tử F có 9 electron. Biểu diễn sự sắp xếp electron ở lớp electron ngoài cùng của nguyên tử F theo ô orbital nào sau đây là đúng?
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p2. Số hiệu nguyên tử của X là
15.
27.
14.
13.
Cấu hình electron của nguyên tử Titanium (Ti; Z = 22) là
1s22s22p63s23p63d24s2.
1s22s22p63s23p64s24p1.
1s22s22p63s23p64s1.
1s22s22p63s23p64s23d2.
Số đơn vị điện tích hạt nhân nguyên tử (kí hiệu là Z) của một nguyên tố bằng
số electron.
số neutron.
số khối.
nguyên tử khối.
Theo mô hình hiện đại về cấu trúc lớp vỏ electron nguyên tử, phát biểu nào sau đây sai?
Electron chuyển động rất nhanh, không theo quỹ đạo xác định xung quanh hạt nhân.
Electron ở xa hạt nhân nhất có năng lượng thấp nhất.
Năng lượng của các electron trên cùng 1 phân lớp electron là bằng nhau.
Các electron sắp xếp thành từng lớp và phân lớp theo các mức năng lượng từ thấp đến cao.
Anion X2- có cấu hình electron ở trạng thái cơ bản 1s22s22p63s23p6.Nguyên tố X là
K (Z=19).
Cl (Z=17).
S (Z=16).
Ca (Z=20).
Phát biểu nào sai khi nói về neutron?
Không mang điện.
Có khối lượng lớn hơn khối lượng electron.
Tồn tại trong hạt nhân nguyên tử.
Chuyển động rất nhanh xung quanh hạt nhân.
Nhận định nào sau đây không đúng?
Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
Nguyên tử có cấu trúc rỗng, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện.
Lớp vỏ nguyên tử chứa electron mang điện tích dương.
Orbital p có dạng
hình số 8 nổi.
hình cầu.
hình bầu dục.
hình tròn.
Nguyên tố hóa học là những nguyên tử có cùng
số proton.
số khối.
số neutron.
số neutron và số proton.
Trong bảng hệ thống tuần hoàn, các nguyên tố thuộc cùng một chu kì thì
nguyên tử của chúng có cùng số lớp electron.
cấu hình electron lớp vỏ giống hệt nhau.
cấu hình electron giống hệt nhau.
nguyên tử của chúng có cùng số phân lớp electron.
Nguyên tố có cấu hình electron 1s22s22p63s23p5 thuộc nhóm
VII A.
I A.
III A.
V A.
Trong trường hợp nào dưới đây, A là phi kim?
ZA = 17.
ZA = 2.
ZA = 11.
ZA = 19.
Cấu hình electron của nguyên tử O (Z = 8) là
1s22s22p6.
1s22s22p4.
1s22s22p2.
2s22p4.
Nguyên tố Y ở dạng ion YO43-, đóng vai trò quan trọng trong các phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng YO43- để vận chuyển năng lượng. Nguyên tử Y có tổng số các loại hạt cơ bản bằng 46, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14 hạt. Vị trí của Y trong bảng tuần hoàn các nguyên tố hoá học là

Hình 1: ADN
ô thứ 17; chu kì 3; nhóm VII A.
ô thứ 17; chu kì 4; nhóm V A.
ô thứ 15; chu kì 3; nhóm III A.
ô thứ 15; chu kì 3; nhóm V A.
Cấu hình electron nào sau đây là của kim loại?
1s22s22p63s1.
1s22s22p63s23p3.
1s22s22p63s23p5.
1s22s22p6.
Số proton và số neutron có trong một nguyên tử sodium () lần lượt là
11 và 12.
11 và 23.
12 và 11.
12 và 23.
Số electron tối đa trong phân lớp s là
10.
2.
14.
6.
Cho các hiện tượng sau đây:
(1) Parafin (nến) cháy;
(2) Muối ăn hòa vào nước;
(3) Cồn để trong lọ không kín bị bay hơi;
(4) Sữa chua lên men;
(5) Rượu để lâu trong không khí thường bị chua.
Số hiện tượng hóa học là
4.
1.
3.
2.
Nguyên tử X có thuộc chu kì 3, nhóm II A trong bảng tuần hoàn. Tính chất của nguyên tố X là
khí hiếm.
không xác định được.
kim loại.
phi kim.
(1 điểm) Trong tự nhiên chlorine (Cl) có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl.
(a) Tính nguyên tử khối trung bình của chlorine.
(b) Hợp chất của chlorine là KClO3 được dùng để chế tạo chất nổ, kíp nổ, sản xuất pháo hoa và một số hợp chất dễ cháy khác. Tính thành phần phần trăm theo khối lượng của 37Cl trong KClO3 (K = 39; O = 16).
(1,5 điểm) Nguyên tử của nguyên tố X có 16 electron; số hạt mang điện nhiều hơn số hạt không mang điện là 14.
(a) Xác định Z, A và viết kí hiệu nguyên tử của nguyên tố X.
(b) Viết cấu hình electron nguyên tử của nguyên tố X.
(c) Cho biết X có tính chất gì (kim loại, phi kim hay khí hiếm)? Giải thích.
(0,5 điểm)Xác định các nguyên tố Y, Z và viết cấu hình electron nguyên tử các nguyên tố này dựa trên các thông tin sau:
a, Nguyên tố Y là nguyên tố phổ biến sau oxy trong vỏ Trái Đất (25,8 %), cứng, có màu xám sẫm - ánh xanh kim loại. Y là nguyên tố cực kỳ cần thiết trong nhiều ngành công nghiệp như chế tạo bê tông, gạch, sản xuất xi măng; Y còn là thành phần tạo ra lớp vỏ bảo vệ tế bào. Nguyên tử nguyên tố Y có 3 lớp electron và có 4 electron ở lớp ngoài cùng.
b, Nguyên tố Z được ứng dụng trong nhiều ngành nghề, lĩnh vực của cuộc sống như: chất tạo màu cho thuỷ tinh; đơn chất Z được dùng để mạ bên ngoài thép để chống han gỉ và là thành phần của thép không gỉ.Nguyên tử nguyên tố Z có 7 electron trên phân lớp s.
Hình 2: Xi măng |
Hình 3: Nồi làm từ thép không gỉ |










