Bộ 3 đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo có đáp án - Đề 2
31 câu hỏi
Hạt mang điện trong hạt nhân nguyên tử là
Electron.
Proton.
Neutron.
Neutron và electron.
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
Sự bài tiết mồ hôi qua da.
Sự tự quay của Trái Đất quanh trục riêng.
Tốc độ của ánh sáng trong chân không.
Sự phân hủy của đá vôi.
Trong nguyên tử, quan hệ giữa số hạt electron và proton là
Số hạt electron lớn hơn số hạt proton.
Số hạt electron nhỏ hơn số hạt proton.
Bằng nhau.
Không thể so sánh được các hạt này.
Nguyên tử oxygen có 8 electron, hạt nhân nguyên tử này có điện tích là
16+.
+ 8.
8.
-8.
Nguyên tố hóa học là tập hợp những nguyên tử có cùng
số neutron và proton.
số neutron.
số proton.
số khối.
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu là
23.
24.
25.
11.
Electron thuộc lớp nào sau đây liên kết chặt chẽ với hạt nhân nhất?
Lớp K.
Lớp L.
Lớp N.
Lớp M.
Orbital nguyên tử là
Đám mây chứa electron dạng hình cầu.
Đám mây chứa electron có dạng hình số 8 nổi.
Khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
Quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
Orbital p có dạng hình gì?
Hình cầu.
Hình tròn.
Hình thoi.
Hình số tám nổi.
Số electron tối đa trong phân lớp p là
2.
10.
6.
14.
Số electron tối đa ở lớp thứ n (n ≤ 4) là
n.
2n.
n2.
2n2.
Lớp N có các phân lớp được kí hiệu lần lượt là
3s, 3p, 3d.
4s, 4p, 4d.
4s, 4p, 4d, 4f.
1s, 2s, 3s, 4s.
Chọn định nghĩa đúng về đồng vị:
Đồng vị là những nguyên tố có cùng số khối.
Đồng vị là những nguyên tử có cùng số neutron và khác proton.
Đồng vị là những nguyên tố có cùng điện tích hạt nhân.
Đồng vị là những nguyên tử có cùng số proton, khác nhau số neutron.
Số nguyên tố trong chu kì 3 và chu kì 5 của bảng tuần hoàn lần lượt là
8 và 18.
8 và 8.
18 và 18.
18 và 32.
Chu kì là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng
số electron.
số lớp electron.
số electron hóa trị
số electron ở lớp ngoài cùng.
Cấu hình electron của nguyên tử nitrogen (Z = 7) là
1s22s22p3.
1s22s32p4.
1s22s22p4.
1s12s12p5.
Mô hình cấu tạo của nguyên tử sodium được biểu diễn như hình bên. Số hạt proton trong hạt nhân nguyên tử Na là
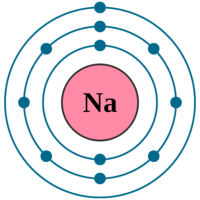
10.
11.
12.
13.
Phát biểu nào sau đây không đúng?
Trong nguyên tử, khối lượng tập trung chủ yếu ở hạt nhân nguyên tử.
Kích thước hạt nhân rất lớn so với kích thước nguyên tử.
Trong nguyên tử, phần không gian rỗng chiếm chủ yếu.
Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là electron.
Oxygen có ba đồng vị với tỉ lệ % số nguyên tử tương ứng là 16O (99,757%), 17O (0,038%), 18O (0,205%). Nguyên tử khối trung bình của oxygen là
16,0.
16,2.
17,0.
18,0.
Nguyên tử X có chứa 13 hạt electron và 14 hạt neutron. Kí hiệu của nguyên tử X là
X.
X.
X.
X.
Các electron của nguyên tố X được phân bố trên 2 lớp, lớp thứ 2 có 7 electron. Số hiệu nguyên tử của nguyên tố X là
7.
8.
9.
10.
Cấu hình electron nào sau đây là của nguyên tử nguyên tố phi kim?
1s2 2s2 2p6 3s2 3p5.
1s2 2s2 2p6 3s2 3p1.
1s2 2s2 2p6 3s2 3p6.
1s2 2s2 2p6 3s2.
Hạt nhân nguyên tử X có 17 proton, 18 neutron. Cấu hình electron nguyên tử Xlà
1s22s22p63s23p6.
1s22s22p63s23p63d1.
1s22s22p63s23p64s1.
1s22s22p63s23p5.
Nguyên tố A có số hiệu nguyên tử là 18, vị trí của A trong bảng tuần hoàn là
chu kì 3, nhóm VIB.
chu kì 3, nhóm VIIIA.
chu kì 3, nhóm VIA.
chu kì 3, nhóm VIIIB.
Một nguyên tố hóa học X ở chu kì 3, nhóm VA. Cấu hình electron của nguyên tử X là
1s22s22p63s23p2.
1s22s22p63s23p4.
1s22s22p63s23p3.
1s22s22p63s23p5.
Phát biếu nào sau đây không đúng?
Electron càng ở xa hạt nhân thì có năng lượng càng thấp.
Số lượng electron tối đa trong một phân lớp luôn là một số chẵn.
Phân lớp p có nhiều orbital hơn phân lớp s.
Số electron tối đa trên phân lớp p gấp ba lần so electron tối đa trên phân lớp s.
Cấu hình electron của nguyên tử nguyên tố X có dạng 1s22s22p63s23p3. Phát biểu nào sau đây là sai?
X thuộc nguyên tố phosphorus.
X là một phi kim.
X có 9 electron p.
X có 3 phân lớp electron.
A được dùng để chế tạo đèn có cường độ sáng cao. Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa electron ở phân lớp 4s. Số hiệu nguyên tử của A là
19.
21.
24.
29.
(1 điểm): Trong tự nhiên potassium (kí hiệu là: K) có hai đồng vị và Tính thành phần phần trăm về khối lượng của có trong KCl (biết nguyên tử khối trung bình của K là 39,13 và Cl là 35,5).
(1 điểm): Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp s là 5. Số electron của X ít hơn số electron của Y là 4 hạt.
(a) Viết cấu hình electron của X, Y.
(b) Xác định vị trí X, Y trong bảng tuần hoàn có giải thích ngắn gọn.
(1 điểm): Tổng số hạt cơ bản của nguyên tử X là 13. Viết cấu hình electron của nguyên tử X và biểu diễn cấu hình electron của X theo ô orbital.








