Bộ 3 đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
21 câu hỏi
A. Phần trắc nghiệm
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Hạt nào sau đây nằm ở lớp vỏ nguyên tử?
Hạt neutron.
Hạt α.
Hạt proton.
Hạt electron.
Trong nguyên tử, hạt nào mang điện?
Neutron và electron.
Proton và electron.
Proton và neutron.
Electron.
X là nguyên tố phổ biến nhất trong Mặt Trời, chiếm khoảng 74% khối lượng Mặt Trời. Biết một loại nguyên tử của nguyên tố X chỉ tạo nên bởi proton và electron (không có neutron). Nguyên tố X là
Lithium.
Carbon.
Helium.
Hydrogen.
Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về
số đơn vị điện tích hạt nhân.
số electron.
số neutron.
số nucleon.
Kim loại R là một thành phần quan trọng của khẩu phần dinh dưỡng. Sự thiếu hụt rất nhỏ của nó sẽ ảnh hưởng tới sự hình thành và phát triển của xương và răng. Hạt nhân nguyên tử R có điện tích +32.10-19 (C). Nguyên tố R có kí hiệu hóa học nào sau đây?
Al (Z = 13).
Na (Z = 11).
Ca (Z = 20).
K (Z = 19).
Nguyên tố M có trong một số loại trái cây, thực phẩm mà chúng ta nạp vào cơ thể hàng ngày. Chúng có tác dụng rất tốt cho việc cải thiện một số chức năng của não bộ và cấu trúc, mật độ xương. Nguyên tử của M có 12 electron, 12 neutron, kí hiệu nguyên tử của nguyên tố M là
\[{}_{12}^{24}M.\]
\[{}_{24}^{12}M.\]
\[{}_{12}^{25}M.\]
\[{}_{25}^{12}M.\]
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
1s22s22p63s23p3.
1s22s22p63s23p5.
1s22s22p53s23p4.
1s22s22p63s23p2.
Hình dưới đây biểu diễn hình dạng của một orbital. Tên gọi của orbital này là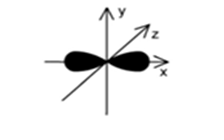
pz.
s.
px
py.
Số AO tối đa trong phân lớp 4p là
5.
1.
3.
7.
Cho cấu hình electron nguyên tử của các nguyên tố sau:
(X) 1s22s22p63s2; (Y) 1s22s22p63s23p64s1;
(Z) 1s22s22p63s23p3; (T) 1s22s22p63s23p63d84s2.
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
X, Z, T.
X, Y, T.
Y, Z, T.
X, Y, Z.
Nguyên tử X có cấu hình electron 1s22s22p63s23p3. X thuộc nhóm
IIIB.
VB.
VA.
IIIA.
Vị trí của nguyên tố có Z = 15 trong bảng tuần hoàn là
Chu kì 3, nhóm VA.
Chu kì 4, nhóm IIA.
Chu kì 4, nhóm VIB.
Chu kì 3, nhóm IIB.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Một loại nguyên tử hydrogen có cấu tạo đơn giản nhất, chỉ tạo nên từ 1 electron và 1 proton. Biết khối lượng của neutron \[ \approx \]1 amu, khối lượng proton \[ \approx \]1 amu, khối lượng của electron \[ \approx \]0,00055 amu.
a. Kích thước của hạt nhân nguyên tử gần bằng kích thước nguyên tử.
b. Đây là nguyên tử nhẹ nhất trong số các nguyên tử được biết cho đến nay.
c. Khối lượng nguyên tử xấp xỉ 2 amu.
d. Hạt nhân nguyên tử có khối lượng lớn gấp khoảng 1818 lần khối lượng lớp vỏ.
Cấu hình electron của nguyên tố aluminium (nhôm) là 1s22s22p63s23p1.
a. Nguyên tử của nguyên tố nhôm có 13 electron.
b. Số hiệu nguyên tử của nguyên tố nhôm là 12.
c. Số electron lớp ngoài cùng của nhôm là 1.
d. Nhôm là nguyên tố phi kim.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 4.
Nguyên tử fluorine có 9 proton, 9 electron và 10 neutron. Số hạt mang điện của nguyên tử fluorine là?
Đáp án đúng là: ……………………
Đồng vị \[{}_9^{18}F\] là một đồng vị phóng xạ được sử dụng trong kĩ thuật chụp PET/CT để phát hiện tế bào ung thư. Số hạt neutron trong một nguyên tử \[{}_9^{18}F\] là?
Đáp án đúng là: ……………………
Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d2. Tổng số electron của nguyên tử nguyên tố X là bao nhiêu?
Đáp án đúng là: ……………………
Cho nguyên tử của nguyên tố X số hiệu nguyên tử là 12. Nguyên tử Y có số electron ở các phân lớp p nhiều hơn số electron các phân lớp p của X là 3 electron. Y ở chu kì mấy trong bảng tuần hoàn?
Đáp án đúng là: ……………………
B. Phần tự luận
Trong tự nhiên chlorine có hai đồng vị bền: \({}_{17}^{37}Cl\) chiếm 24,23% tổng số nguyên tử, còn lại là \({}_{17}^{35}Cl\). Tính phần trăm theo khối lượng của \({}_{17}^{37}Cl\) trong HClO4 (biết H = 1, O = 16).
Nguyên tử copper ở ô số 29, nhóm IB. Cấu hình electron của nguyên tử copper là?
Cho X và Y là hai nguyên tố thuộc cùng nhóm và ở hai chu kì liên tiếp. Tổng số proton của X và Y là 32. X và Y là?








