Bộ 3 đề thi cuối kì 1 Hóa 10 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
21 câu hỏi
Số hiệu nguyên tử của một nguyên tố là
điện tích hạt nhân nguyên tử của nguyên tố đó
số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó
tổng số proton và neutron trong nguyên tử của nguyên tố đó
tổng số proton và electron trong nguyên tử của nguyên tố đó
Nguyên tử sodium (Na) có Z = 11. Cấu hình electron của Na+ là
1s22s22p6.
1s22s22p63s1.
1s22s22p63s2.
1s22s22p5.
Nhóm A gồm những loại nguyên tố nào sau đây?
Nguyên tố s và nguyên tố p.
Nguyên tố d và nguyên tố f.
Nguyên tố s và nguyên tố d.
Nguyên tố p và nguyên tố f.
Trong nguyên tử, hạt nào mang điện tích dương?
Proton.
Electron.
Neutron.
Neutron và proton.
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì
phi kim mạnh nhất là fluorine.
phi kim mạnh nhất là bromine.
kim loại mạnh nhất là lithium.
kim loại yếu nhất là caesium.
Nguyên tố X có Z = 19. Công thức oxide và hydroxide cao nhất của X lần lượt là
Na2O, NaOH.
SO3; H2SO4.
K2O; KOH.
KO, K(OH)2.
Nitrogen là nguyên tố thuộc chu kì 2 và nhóm VA trong bảng tuần hoàn. Nitrogen có xu hướng nhường hay nhận bao nhiêu electron để đạt được cấu hình electron bền vững?
Nhường 5 electron.
Nhận 3 electron.
Nhường 3 electron.
Nhận 5 electron.
Hợp chất trong phân tử có liên kết ion là
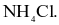
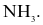
HBr.
Chất vừa có liên kết cộng hoá trị phân cực, vừa có liên kết cộng hoá trị không phân cực là
CO₂.
H₂O.
NH3.
C₂F6.
Cho các phát biểu về các loại liên kết?
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Số phát biểu đúng là
1.
2.
3.
4.
Cho biết các giá trị độ âm điện của nguyên tử các nguyên tố sau: K (0,82); Al (1,61); H (2,20); O (3,44); S (2,58); Br (2,96) và Cl (3,16). Hợp chất nào sau đây có liên kết ion trong phân tử?
SO2.
AlCl3.
2O.
KBr.
Nhận xét nào sau đây đúng khi nói về phân tử khí cacbonic (CO2), biết CO2 có cấu trúc thẳng?
Liên kết giữa C và O là cộng hóa trị không cực, CO2 là phân tử có cực.
Liên kết giữa C và O là cộng hóa trị có cực, CO2 là phân tử có cực.
Liên kết giữa C và O là cộng hóa trị không cực, CO2 là phân tử không cực.
Liên kết giữa C và O là cộng hóa trị có cực, CO2 là phân tử không cực.
Nguyên tố X ở ô thứ 17 của bảng tuần hoàn. Cho các phát biểu sau:
(a) X có độ âm điện lớn và là một phi kim mạnh
(b) X có thể tạo thành ion bền có dạng 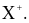
(c) Oxide cao nhất của X có công thức 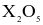 và là acidic oxide.
và là acidic oxide.
(d) Hydroxide của X có công thức 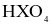 và là acid mạnh.
và là acid mạnh.
Sodium fluoride (NaF) là thành phần hoạt chất phổ biến nhất trong kem đánh răng để ngăn ngừa sâu răng, hình thành men răng.
(a) Trong phân tử NaF, các nguyên tử Na và F đều đã đạt cấu hình bền của khí hiếm gần nhất.
(b) NaF là hợp chất cộng hóa trị phân cực.
(c) Khi hình thành liên kết trong phân tử NaF, nguyên tử Na có xu hướng nhường 1 electron, nguyên tử F có xu hướng nhận 1 electron.
(d) Nguyên tử Na có 2 electron hóa trị, nguyên tử F có 5 electron hóa trị.
Cấu hình electron của nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 9. Số electron lớp ngoài cùng của X là?
Nguyên tử của một nguyên tố X có cấu hình electron: [Ar]4s2. Nguyên tố này là một trong những nguyên tố thiết yếu cho cơ thể, được bổ sung trong các sản phẩm sữa. Cho biết X nằm ở ô bao nhiêu trong bảng tuần hoàn.
Biết độ âm điện của H, Br, C, O và Mg lần lượt là 2,20; 2,96; 2,55; 3,44; 1,31. Trong các chất sau: H2, HBr. CO2, MgO. Số hợp chất ion là?
Trong các phân tử sau: H2O, CH4, NH3, HF, CO2, H2. Số phân tử có thể tạo liên kết hydrogen với phân tử nước là bao nhiêu?
(1 điểm) Chlorine có hai đồng vị bền 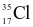 và
và 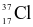 . Nguyên tử khối trung bình của chlorine là 35,5. Nếu có 300 nguyên tử
. Nguyên tử khối trung bình của chlorine là 35,5. Nếu có 300 nguyên tử 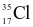 thì số lượng nguyên tử
thì số lượng nguyên tử 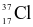 là bao nhiêu?
là bao nhiêu?
(1 điểm) Xét 3 nguyên tố X, Y, T có số thứ tự và cấu hình electron tương ứng như sau:
X: 1s22s1 (1)
Y: 1s22s22p63s1 (2)
T: 1s22s22p63s23p64s1 (3)
Sắp xếp các nguyên tố trên theo chiều tăng dần tính kim loại, có giải thích ngắn gọn cách sắp xếp.
(1 điểm) Trình bày sự hình thành liên kết cộng hóa trị trong phân tử hydrogen chloride (HCl).








