Bộ 3 đề thi cuối kì 1 Hóa 10 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
21 câu hỏi
Các nguyên tử thuộc cùng về một nguyên tố hóa học khi
có cùng số hạt proton.
có cùng số hạt neutron.
có cùng số hạt electron và neutron.
có cùng khối lượng nguyên tử.
Nguyên tử K có Z = 19. Cấu hình electron của K là
[Ar]4s1.
[Ar]3d1.
[Ar]4s2.
[Ar]3d2.
Số thứ tự của ô nguyên tố bằng
số hiệu nguyên tử.
số neutron.
số lớp electron.
số electron lớp ngoài cùng.
Nguyên tử được tạo nên từ các hạt cơ bản là
proton, neutron và electron.
proton và neutron.
proton và electron.
neutron và electron.
Độ âm điện (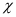 ) là đại lượng đặc trưng cho
) là đại lượng đặc trưng cho
khả năng nhường electron liên kết của một nguyên tử trong phân tử.
khả năng hút electron liên kết của một nguyên tử trong phân tử.
số nguyên tử của một nguyên tố trong phân tử.
khối lượng của nguyên tố trong phân tử.
Công thức hydroxide của nguyên tố Na (Z = 11) và nguyên tố S (Z = 16) lần lượt là
NaOH; H2SO3.
Na(OH)2; H2SO4.
NaOH; H2SO4.
Na(OH)2, H2SO3.
Khi hình thành liên kết hóa học, nguyên tử nào sau đây có xu hướng nhường 1 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
Al (Z = 13).
F (Z = 9).
Na (Z = 11).
Ne (Z = 10).
Liên kết hóa học là
sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
sự kết hợp của các phân tử hình thành các chất bền vững.
sự kết hợp của chất tạo thành vật thể bền vững.
Trong các phân tử  số lượng phân tử chỉ chứa các liên kết cộng hoá trị không phân cực là
số lượng phân tử chỉ chứa các liên kết cộng hoá trị không phân cực là
2.
3.
4.
5.
Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử?
2H5OH.
NH3.
HF.
CH4.
Cho 2 nguyên tử có cấu hình electron ở trạng thái cơ bản như sau: 1s22s1 và 1s22s22p5. Hai nguyên tử này kết hợp nhau bằng loại liên kết gì để tạo thành hợp chất?
Liên kết cộng họa trị có cực.
Liên kết ion.
Liên kết cộng hóa trị không cực.
Liên kết kim loại.
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
Phân tử HCl là phân tử phân cực.
Các electron liên kết bị hút lệch về một phía nguyên tử chlorine.
Cặp electron dùng chung nằm chính giữa hai nguyên tử hydrogen và chlorine.
Nguyên tử hydrogen và chlorine liên kết với nhau bằng một liên kết đơn.
Phân tử 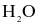 có cấu tạo như sau:
có cấu tạo như sau:
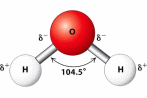
(a) Liên kết H–O là liên kết cộng hoá trị không phân cực.
(b) Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
(c) Nguyên tử O còn một cặp electron hoá trị riêng.
(d) Các phân tử H2O có khả năng tạo liên kết hydrogen với nhau.
X là nguyên tố chu kì 2, phân lớp ngoài cùng của nguyên tử nguyên tố X có 3 electron độc thân. Mỗi phát biểu sau là đúng hay sai?
(a) Số electron lớp ngoài cùng của X là 3.
(b) X là nguyên tố nhóm IIIA hoặc IIIB.
(c) X là một kim loại.
(d) Số electron lớp ngoài cùng của X là 5.
Cấu hình electron nguyên tử nguyên tố X là: 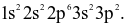 Cho biết số electron độc thân của X ở trạng thái cơ bản?
Cho biết số electron độc thân của X ở trạng thái cơ bản?
Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Số electron phân lớp ngoài cùng của nguyên tử phosphorus là bao nhiêu?

Trong công thức 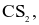 tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là?
tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là?
Trong dung dịch ethanol (C2H5OH) có bao nhiêu loại liên kết hydrogen được tạo thành?
(1 điểm) Trong tự nhiên iron (kí hiệu Fe hay gọi là sắt) có hai đồng vị là 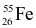 và
và 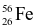 . Nguyên tử khối trung bình của Fe bằng 55,85. Thành phần phần trăm số nguyên tử của mỗi đồng vị
. Nguyên tử khối trung bình của Fe bằng 55,85. Thành phần phần trăm số nguyên tử của mỗi đồng vị 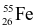 và
và 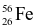 lần lượt là?
lần lượt là?
(1 điểm) Nguyên tố sulfur (S) ở ô số 16, chu kì 3, nhóm VIA của bảng tuần hoàn.
(a) Viết cấu hình electron nguyên tử của sulfur.
(b) Nêu một số tính chất cơ bản của đơn chất và oxide, hydroxide chứa sulfur.
(1 điểm) Viết công thức electron, công thức cấu tạo và công thức Lewis của phân tử NH3.








