Bộ 3 đề thi cuối kì 1 Hóa 10 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
21 câu hỏi
Trong bảng tuần hoàn các nguyên tố hóa học, tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron gọi là
ô nguyên tố.
nhóm.
chu kì.
dãy nguyên tố.
Trong nguyên tử, hạt nào không mang điện tích?
Proton.
Electron.
Neutron.
Neutron và proton.
Nguyên tử khối là
khối lượng tuyệt đối của một nguyên tử.
khối lượng tương đối của một nguyên tử.
tổng số hạt proton, neutron và electron trong nguyên tử.
tổng số proton và electron trong nguyên tử.
Nguyên tử Iron (Fe) có Z = 26. Cấu hình electron của nguyên tử Fe là
[Ar]4s23d6.
[Ar]3d6.
[Ar]3d64s2.
[Ar]4s2.
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng
tăng dần.
giảm dần.
không thay đổi.
giảm sau đó tăng dần.
Phân tử nào sau đây chứa nguyên tử không tuân theo quy tắc octet?
Biết: H (Z = 1), B (Z = 5), C (Z = 6), N (Z = 7), O (Z = 8).
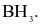
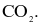
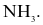
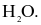
Liên kết ion có bản chất là
sự dùng chung các electron.
lực hút tĩnh điện của các ion mang điện tích trái dấu.
lực hút tĩnh điện giữa cation kim loại với các electron tự do.
lực hút giữa các phân tử.
Nguyên tử của nguyên tố chlorine có Z = 17. Hydroxide cao nhất của nguyên tố này có
tính acid mạnh.
tính acid yếu.
tính base mạnh.
tính base yếu.
Các nguyên tố F, Cl, Br và I đều thuộc nhóm VIIA và ở các chu kì tương ứng là 2, 3, 4 và 5. Dựa vào độ âm điện, liên kết cộng hoá trị trong phân tử HX (X là F, Cl, Br, I) nào phân cực mạnh nhất?
HF.
HCl.
HBr.
HI.
Giữa các nguyên tử khí hiếm Ar, có thể hình thành loại liên kết hay tương tác hoá học nào?
Liên kết ion.
Liên kết cộng hoá trị.
Liên kết hydrogen.
Tương tác van der Waals.
Ion X- có cấu hình electron là 1s22s22p6, nguyên tử Y có số electron ở các phân lớp s là 5. Liên kết giữa X và Y thuộc loại liên kết nào sau đây?
cộng hóa trị phân cực.
cho nhận.
ion.
cộng hóa trị.
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
3.
6.
5.
4.
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là 1s22s22p63s1; 1s22s22p63s2; 1s22s22p63s23p1.
(a) X, Y, Z thuộc cùng một nhóm IIIA trong bảng tuần hoàn.
(b) X, Y, Z thuộc chu kì 3 trong bảng tuần hoàn.
(c) Tính kim loại giảm dần theo thứ tự: X, Y, Z.
(d) Z có bán kính nguyên tử lớn nhất trong 3 kim loại.
Cho các nhận định sau về liên kết hóa học:
(a) Các orbital p vừa có khả năng xen phủ tạo liên kết vừa có khả năng xen phủ tạo liên kết tuỳ thuộc vào kiểu xen phủ.
(b) Liên kết cộng hoá trị không phân cực chỉ có thể tạo thành từ các nguyên tử của cùng một nguyên tố hoá học.
(c) Tất cả các nguyên tử khi tham gia tạo thành liên kết cộng hoá trị đều thoả mãn quy tắc octet.
(d) Hiệu độ âm điện giữa hai nguyên tử càng cao thì liên kết càng phân cực.
Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Có bao nhiêu nguyên tố phù hợp với X?
Nguyên tố R thuộc nhóm IVA trong bảng tuần hoàn. Hợp chất khí của R với hydrogen có 25% H về khối lượng. R thuộc chu kì mấy trong bảng tuần hoàn?
Tổng số các phân tử không có cực trong số các phân tử sau: 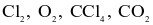 và
và 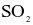 là bao nhiêu?
là bao nhiêu?
Cho các phân tửH2O, NH3, HF, H2S, CO2, HCl. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là?
(1 điểm) Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên zirconium (kí hiệu Zr) có các đồng vị được thể hiện qua biểu đồ và bảng sau:
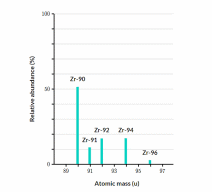
| Khối lượng nguyên tử (amu) | 90 | 91 | 92 | 94 | 96 |
| % đồng vị | 51,45 | 11,22 | 17,15 | 17,38 | 2,8 |
Xác định nguyên tử khối trung bình của zirconium. (Làm tròn kết quả đến hàng phần mười)
(1 điểm) Cho các phi kim: P (Z = 15), O (Z = 8) và S (Z = 16). Hãy sắp xếp các phi kim này theo chiều tăng dần tính phi kim, có giải thích ngắn gọn cách xác định.
(1 điểm). Mô tả sự tạo thành liên kết ion trong magnesium oxide (MgO).








