Bộ 5 đề thi giữa kì Hóa 10 Kết nối tri thức (2023-2024) có đáp án - Đề 3
31 câu hỏi
Cấu hình electron của:
Nguyên tử X: 1s22s22p63s23p64s2
Nguyên tử Y: 1s22s22p63s23p5
Nhận định nào sau đây là đúng?
X và Y có cùng số lớp.
Nguyên tử X dễ nhường electron hơn nguyên tử Y.
Nguyên tử Y có tổng số hạt ít hơn tổng số hạt nguyên tử X là 6 hạt.
X là phi kim, Y là kim loại.
Định tuổi bằng carbon phóng xạ là phương pháp định tuổi bằng đồng vị phóng xạ sử dụng () để xác định tuổi của vật liệu hay mẫu có chứa carbon với độ tuổi lên tới 60.000 năm. Vậy trong hạt nhân của nguyên tửchứa nhiều hơn nguyên tử đồng vị bền là bao nhiêu hạt?
1.
2.
4.
3.
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
electron và proton.
proton và neutron.
neutron và electron.
electron, proton và neutron.
Cấu hình electron của nguyên tử Phosphorus (Z = 15) theo ô orbital là:




Nguyên tố nào sau đây thuộc nguyên tố s?
.
.
.
.
Thông tin nào sau đây không đúng?
Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu.
Neutron không mang điện, khối lượng gần bằng 1 amu.
Nguyên tử trung hòa điện, có kích thước lớn hơn nhiều so với hạt nhân, nhưng có khối lượng gần bằng khối lượng hạt nhân.
Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu.
Vùng không gian xung quanh hạt nhân có thể tìm thấy electron được gọi là
vùng tìm thấy.
orbital nguyên tử.
vùng xác định.
orbital hạt nhân.
Theo mô hình Rutherford-Bohr, chuyển động của các electron xung quanh hạt nhân có quỹ đạo
không xác định.
gấp khúc.
tròn hoặc bầu dục.
vuông.
Nguyên tố hóa học là tập hợp những nguyên tử có cùng
khối lượng.
đơn vị điện tích hạt nhân (Z).
số neutron.
số electron.
Đối tượng nghiên cứu của hoá học là
Các kim loại.
Các hạt cấu tạo nên nguyên tử.
Các đơn chất và hợp chất.
Chất và sự biến đổi chất.
Số electron tối đa trong một orbital nguyên tử là
1.
3.
4.
2.
Số trong một phân lớp là
3
4
1.
6.
Nguyên tử X có chứa 7 proton và 8 neutron. Kí hiệu nguyên tử của X là
.
.
.
.
Hình nào sau đây biểu diễn orbital s?
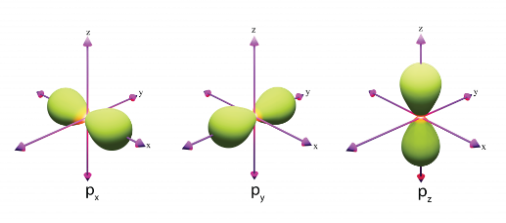 .
.
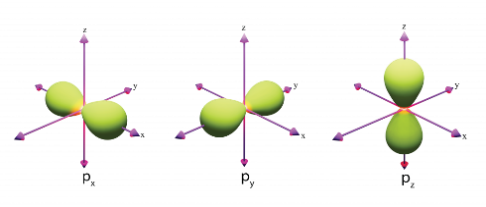 .
.
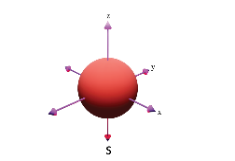 .
.
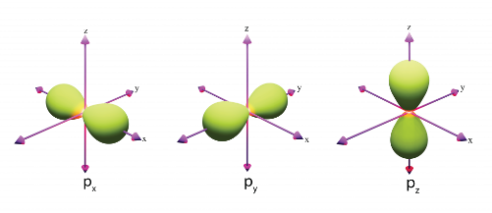 .
.
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu là
58
39
20
19
Vỏ của nguyên tử được cấu tạo bởi
hạt electron và hạt proton.
hạt neutron và hạt proton.
hạt electron.
hạt neutron.
Nguyên tử chứa những hạt mang điện là
proton và neutron.
electron và neutron.
proton và α.
proton và electron.
Ngành nào sau đây không liên quan đến hóa học?
Vũ trụ.
Dược phẩm.
Năng lượng.
Mĩ phẩm.
Số khối của một nguyên tử là
A = số p + số e.
A = 2p.
A = số p + số e + số n.
A = số p + số n.
Sự phân bố electron vào các lớp và phân lớp căn cứ vào
số khối tăng dần.
điện tích hạt nhân tăng dần.
nguyên tử khối tăng dần.
mức năng lượng electron.
Đồng vị là những nguyên tử có
cùng số neutron.
cùng số neutron, khác số proton.
cùng số proton, khác số neutron.
cùng số proton.
Cho các nguyên tử sau: . Các nguyên tử nào thuộc cùng một nguyên tố hóa học?
X và K, Y và L.
X và Y, Z và K.
Y và L, Z và M.
X và Z, Y và K.
Phát biểu nào sau đây không đúng?
Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
Vỏ nguyên tử được cấu thành bởi các hạt electron.
Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron.
Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Cho các nguyên tố sau: . Nguyên tố nào sau đây không thuộc cùng một nhóm với các nguyên tố khác?
Be.
.
O.
Ca.
Bảng tuần hoàn hiện nay sắp xếp các nguyên tố theo chiều tăng dần
số khối.
điện tích hạt nhân.
khối lượng nguyên tử.
bán kính nguyên tử.
Chu kì là dãy nguyên tố mà nguyên tử của chúng có số lớp e, được sắp xếp như thế nào?
Giảm dần của điện tích hạt nhân.
Tăng dần của điện tích hạt nhân.
Tăng dần của khối lượng nguyên tử.
Giảm dần của khối lượng nguyên tử.
Lớp có bao nhiêu phân lớp?
4.
1.
3.
2.
Ở trạng thái cơ bản, cấu hình electron của nguyên tử sodium (Z = 11) là
1s22s22p63s1.
1s22s22p43s1.
1s22s22p63s2.
1s22s22p53s2.
(1,0 điểm) Hoàn thành các thông tin trong bảng sau:
Nguyên tố | Kí hiệu | Số hiệu nguyên tử | Số khối | Số proton | Số neutron | Số electron |
Sodium | Na | 11 | 23 | ? | ? | 11 |
Bromine | Br | ? | ? | 35 | 45 | ? |
a) (0,5đ) Dựa vào hình 1 hãy:
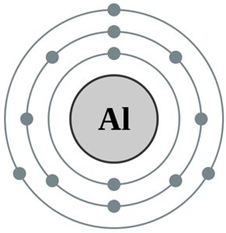
Hình 1: Mô hình của Rutherford – Bohr mô tả sự chuyện động của electron trong nguyên tử Aluminium (Al)
+ Xác định tổng số electron,số lớp electron và số electron trên mỗi lớp của Al.
+ Viết cấu hình electron của nguyên tử Al và biểu diễn cấu hình electron theo AO.
+ Xác định số electron lớp ngoài cùng và số electron độc thân của nguyên tử Al.
+ Nguyên tử Al là kim loại, phi kim hay khí hiếm, giải thích?
b) (0,5đ) Từ cấu hình electron của Al ở câu a, hãy dự đoán vị trí ô, chu kì, nhóm và loại nguyên tố của Al trong bảng tuần hoàn hóa học. Giải thích?
(1,0 điểm)
a) Dựa vào phổ khối lượng ở hình 2 hãy viết kí hiệu hóa học các nguyên tử đồng vị bền và tính nguyên tử khối trung bình của Li (Z=3).
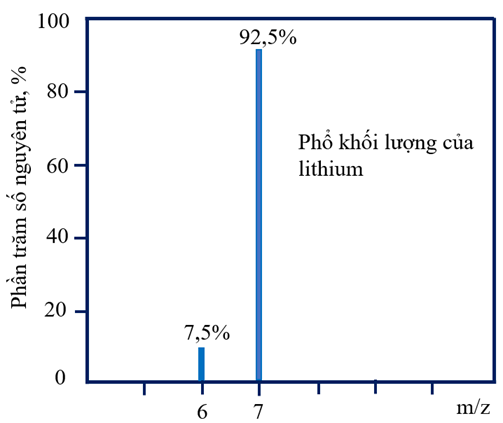 Hình 2. Phổ khối lượng của lithiumb) (0,5đ) Pin Lithium (Lithium Battery) là loại pin có mật động năng lượng cao, so với các dòng pin cũ như acquy có mật động năng lượng cao hơn tới 100 lần. Pin Lithium thường được dùng cho các thiết bị di động như điện thoại, máy tính,… và được sử dụng là nguồn lưu trữ năng lượng như pin sạc của các vật dụng tích điện như sạc dự phòng điện thoại. Giả sử trong một viên pin Lithium 48,5g chứa khoảng 40% khối lượng Lithium nguyên chất. Tính số nguyên tử trong viên pin đó. Biết số Avogadro có giá trị nguyên tử/mol.
Hình 2. Phổ khối lượng của lithiumb) (0,5đ) Pin Lithium (Lithium Battery) là loại pin có mật động năng lượng cao, so với các dòng pin cũ như acquy có mật động năng lượng cao hơn tới 100 lần. Pin Lithium thường được dùng cho các thiết bị di động như điện thoại, máy tính,… và được sử dụng là nguồn lưu trữ năng lượng như pin sạc của các vật dụng tích điện như sạc dự phòng điện thoại. Giả sử trong một viên pin Lithium 48,5g chứa khoảng 40% khối lượng Lithium nguyên chất. Tính số nguyên tử trong viên pin đó. Biết số Avogadro có giá trị nguyên tử/mol.








