Bộ 3 đề thi giữa kì 1 Hóa 10 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
Sự lớn lên và sinh sản của tế bào.
Cấu tạo của chất và sự biến đổi của chất.
Quá trình ra mực của bút bi.
Sự hình thành hệ Mặt Trời.
Trong nguyên tử, hạt mang điện tích dương là
neutron và proton.
proton.
electron.
neutron.
Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
Electron, m ≈ 1 amu, q = -1.
Proton, m≈ 1 amu, q = -1.
Proton, m ≈ 0,00055 amu, q = +1.
Neutron, m ≈ 1 amu, q = 0.
Phát biểu nào dưới đây không đúng?
Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
Hạt nhân của tất cả các nguyên tử đều có 2 loại hạt: proton và neutron.
Thí nghiệm bắn phá lá vàng của Rutherford cho thấy nguyên tử có cấu tạo rỗng.
Nguyên tử là trung hòa về điện.
Nguyên tố hóa học là những nguyên tử có cùng
số neutron và số proton.
số khối.
số neutron.
số proton.
Chọn phát biểu đúng khi nói về nguyên tử \[{}_{12}^{24}Mg\] trong các phát biểu sau?
Mg có 12 electron.
Mg có 24 proton.
Mg có 24 electron.
Mg có 24 neutron.
X và Y là đồng vị của cùng một nguyên tố hóa học. Phát biểu nào sau đây đúng?
X và Y có cùng số hạt neutron và khác số hạt proton.
X và Y có cùng số hạt electron và khác số hạt proton.
X và Y có cùng số hạt proton và khác số hạt electron.
X và Y có cùng số hạt proton và khác số hạt neutron.
Nguyên tử fluorine chứa 9 electron và có số khối là19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
30.
32.
19.
28.
Trong tự nhiên hydrogen có 3 đồng vị: 1H, 2H, 3H. Oxygen có 3 đồng vị 16O, 17O, 18O. Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên?
3.B. 16.C. 18. D. 9.
16.
18.
9.
Sự phân bố electron vào các lớp và phân lớp căn cứ vào
nguyên tử khối tăng dần.
điện tích hạt nhân tăng dần.
số khối tăng dần.
mức năng lượng electron.
Phân lớp 3p có số electron tối đa là
6.
18.
14.
10.
Orbital có dạng hình cầu là
orbital s.
orbital p.
orbital f.
orbital d.
Trong bảng hệ thống tuần hoàn hiện tại các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là
3 và 3.
4 và 3.
3 và 4.
4 và 4.
Khi nói về chu kì, phát biểu nào sau đây không đúng?
Bảng tuần hoàn hiện tại có 7 chu kì.
Tất cả các chu kì mở đầu là một kim loại điển hình và kết thúc là một phi kim điển hình.
Trong một chu kì, các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
Trong cùng một chu kì, các nguyên tử có cùng số lớp electron.
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIIA trong bảng tuần hoàn các nguyên tố hóa học đều là
np3.
ns3.
ns2np1.
ns2np4.
Bảng tuần hoàn các nguyên tố hóa học gồm 8 nhóm A và 8 nhóm B, tương ứng với số cột:
8.
18.
16.
20.
Nguyên tố R thuộc chu kì 2, nhóm VIIIA. Cấu hình electron của R là
1s22s22p6.
1s22s22p8.
1s22s22p4.
1s22s32p5.
Cho biết nguyên tố A có 15 proton trong hạt nhân. A là
kim loại.
phi kim.
khí hiếm.
khí trơ.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Một loại nguyên tử hydrogen có cấu tạo đơn giản nhất, chỉ tạo nên từ 1 electron và 1 proton. Biết khối lượng của neutron \[ \approx \]1 amu, khối lượng proton \[ \approx \]1 amu, khối lượng của electron \[ \approx \]0,00055 amu.
a. Đây là nguyên tử nhẹ nhất trong số các nguyên tử được biết cho đến nay.
b. Khối lượng nguyên tử xấp xỉ 2 amu.
c. Hạt nhân nguyên tử có khối lượng lớn gấp khoảng 1818 lần khối lượng lớp vỏ.
d. Kích thước của nguyên tử bằng kích thước của hạt nhân.
Nguyên tử của nguyên tố X có kí hiệu như sau: \[{}_{13}^{27}X\].
a. Lớp vỏ nguyên tử của nguyên tố X có 13 electron.
b. Điện tích hạt nhân nguyên tử X là +14.
c. Nguyên tử của nguyên tố X có 13 proton và 14 neutron.
d. Tên gọi của X là magnesium.
X là một trong những nguyên tố có mặt trong nước Javel – nước tẩy trắng quần áo, sợi vải. Y là một nguyên tố khoáng có ý nghĩa quan trọng đối với sự phát triển của hệ xương khớp. Anion X- và cation Y2+ đều có cấu hình e lớp ngoài cùng là 3s23p6.
a. Cấu hình electron của X là [Ar]4s1.
b. Cấu hình electron của Y là [Ar]4s2.
c. Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 1 electron độc thân.
d. Ở trạng thái cơ bản, nguyên tử của nguyên tố Y có 2 electron độc thân.
Cấu hình electron của nguyên tử nguyên tố X có dạng 1s22s22p5.
a. X ở chu kì 2.
b. X thuộc nhóm VA.
c. X là một phi kim.
d. X ở ô số 9 trong bảng tuần hoàn.
Phần III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là?
Nguyên tố R có cấu hình electron 1s22s22p63s23p63d34s2. R thuộc họ nguyên tố nào?
Hợp kim chứa nguyên tố X nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố X còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng. Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40. Trong nguyên tử X, tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12. Số proton và neutron trong X lần lượt là?
Nguyên tố phosphorus có Z = 15, có trong thành phần của một số loại phân bón, diêm, pháo hoa…. Vị trí của P (số thứ tự của ô nguyên tố, chu kì và nhóm) trong bảng tuần hoàn là?
Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của bạc (Silver) được biểu diễn như hình sau:
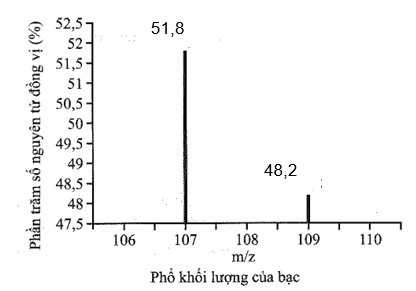
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối của mỗi đồng vị với điện tích của các ion đồng vị tương ứng. Nguyên tử khối trung bình của Ag là
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp s là 5. Số electron của X ít hơn số electron của Y là 5 hạt. Y thuộc nhóm nào trong bảng tuần hoàn?








