Bộ 3 đề thi giữa kì 1 Hóa 10 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Mô hình cấu tạo của nguyên tử potassium (K) được biểu diễn như hình bên. Số hạt proton trong hạt nhân nguyên tử K là 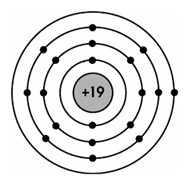
18.
19.
20.
17.
Các hạt cấu tạo nên hầu hết các nguyên tử là
electron và neutron.
electron, proton và neutron.
neutron và electron.
proton và neutron.
Trong nguyên tử, hạt mang điện là
proton và neutron.
electron.
electron và neutron.
proton và electron.
Nếu phóng đại một nguyên tử vàng lên 1 tỉ (109) lần thì kích thước của nó tương đương một quả bóng rổ (có đường kính 30 cm) và kích thước của hạt nhân tương đương một hạt cát (có đường kính 0,003cm). Tỉ lệ kích thước giữa nguyên tử vàng và hạt nhân là
10 000.
100.
1 000.
10.
Hạt nhân nguyên tử Na có số proton là 11 và số neutron là 12. Số khối của hạt nhân nguyên tử sodium là
22.
24.
23.
11.
Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về
số đơn vị điện tích hạt nhân.
số electron.
số neutron.
số nucleon.
Đồng vị\[{}_9^{18}F\]là một đồng vị phóng xạ được sử dụng trong kĩ thuật chụp PET/CT để phát hiện tế bào ung thư. Số hạt neutron trong một nguyên tử \[{}_9^{18}F\]là
10.
19.
18.
9.
Kim loại R là một thành phần quan trọng của khẩu phần dinh dưỡng. Sự thiếu hụt rất nhỏ của nó sẽ ảnh hưởng tới sự hình thành và phát triển của xương và răng. Hạt nhân nguyên tử R có điện tích +32.10-19 (C). Nguyên tố R có kí hiệu hóa học nào sau đây?
Al (Z = 13).
Na (Z = 11).
Ca (Z = 20).
K (Z = 19).
Nguyên tố M có trong một số loại trái cây, thực phẩm mà chúng ta nạp vào cơ thể hàng ngày. Chúng có tác dụng rất tốt cho việc cải thiện một số chức năng của não bộ và cấu trúc, mật độ xương. Nguyên tử của M có 12 electron, 12 neutron, kí hiệu nguyên tử của nguyên tố M là
\[{}_{12}^{24}M.\]
\[{}_{24}^{12}M.\]
\[{}_{12}^{25}M.\]
\[{}_{25}^{12}M.\]
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
1s22s22p63s23p3.
1s22s22p63s23p5.
1s22s22p53s23p4.
1s22s22p63s23p2.
Hình dưới đây biểu diễn hình dạng của một orbital. Tên gọi của orbital này là
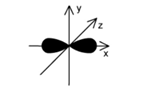
pz.
s.
px
py.
Số AO trong phân lớp 2p là
5.
1.
3.
7.
Số chu kì trong bảng hệ thống tuần hoàn hiện tại là
8.
18.
7.
16.
Theo tiến trình lịch sử, ngày nay các nhà khoa học đã sắp xếp các nguyên tố hóa học trong bảng tuần hoàn dựa trên cơ sở
Theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Theo chiều tăng dần của khối lượng nguyên tử.
Theo chiều tăng dần số neutron.
Theo chiều tăng dần của số khối.
Trong bảng tuần hoàn, chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng
cấu hình electron.
số lớp electron.
số electron.
số electron lớp ngoài cùng.
Nguyên tử sulfur có cấu hình electron lớp ngoài cùng là 3s23p4. Vị trí (chu kì, nhóm) của nguyên tố sulfur trong bảng tuần hoàn là
chu kì 4, nhóm IIA.
chu kì 4, nhóm IIIA.
chu kì 3, nhóm VIA.
chu kì 3, nhóm IVA.
Số nguyên tố trong chu kì 3 của bảng tuần hoàn các nguyên tố hoá học là
32.
2.
8.
18.
Nguyên tử X có 15 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
chu kì 4.
chu kì 2.
chu kì 5.
chu kì 3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Nguyên tử của nguyên tố X có 4 lớp electron, có mức năng lượng cao nhất ở phân lớp 3d, phân lớp ngoài cùng đã bão hòa electron.
a. X có 2 electron ở lớp ngoài cùng.
b. Tổng số electron s và electron p của X là 20.
c. Có 8 cấu hình electron thỏa mãn đặc điểm của X.
d. Cấu hình electron của X là 1s22s22p63s23p64s2.
Magnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng của cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích z của các ion đồng vị của magnesium đều bằng +1):
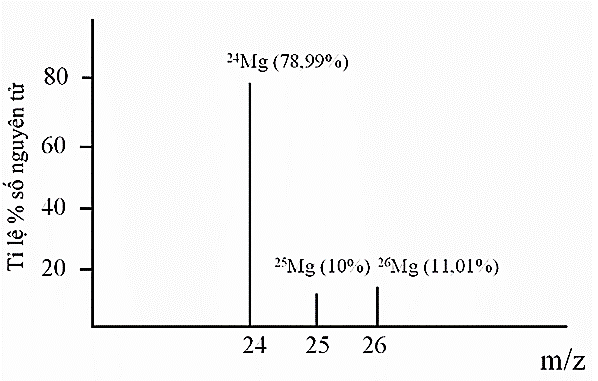
a. Magnesium có 3 đồng vị bền.
b. Phần trăm số nguyên tử của đồng vị 25Mg là lớn nhất.
c. Phần trăm số nguyên tử của đồng vị 24Mg là nhỏ nhất.
d. Nguyên tử khối trung bình của magnesium là 24,00.
Xét đặc điểm của các hạt cơ bản: proton, neutron, electron.
a. Hạt proton có điện tích tương đối là +1 và khối lượng xấp xỉ 1 gam.
b. Hạt neutron không mang điện và khối lượng xấp xỉ 1 amu.
c. Hạt electron có điện tích tương đối là -1 và khối lượng là 0,00055 amu.
d. Trong nguyên tử khối lượng electron rất nhỏ so với khối lượng của proton và neutron nên khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân.
Nguyên tử X có phân lớp electron ngoài cùng là 3p4.
a. Lớp ngoài cùng của X có 6 electron.
b. Hạt nhân nguyên tử X có 16 electron.
c. Trong bảng tuần hoàn X nằm ở chu kì 3.
d. X nằm ở nhóm VIIA.
Phần III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Nguyên tố Y được dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy. Cấu hình electron nguyên tử Y (Z = 16) ở trạng thái cơ bản là?
Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định thành phần các hạt cấu tạo nên nguyên tử X.
Cho phổ khối của nguyên tố R như sau:
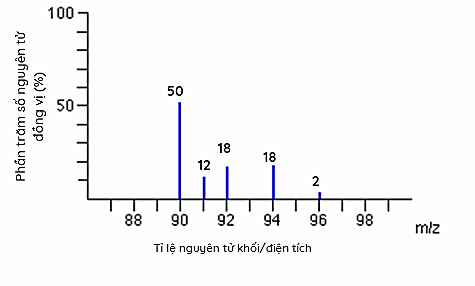
Nguyên tử khối trung bình của nguyên tố R là
Hai nguyên tố A và B thuộc cùng một nhóm chính (nhóm A) và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số hiệu nguyên tử của 2 nguyên tố A, B là 22. Các nguyên tố A, B là?
Nguyên tử chromium ở ô số 24 trong bảng tuần hoàn. Cấu hình electron của nguyên tử chromium là?
Nguyên tố X có cấu hình electron ở phân lớp ngoài cùng là 3p3. Vị trí (ô, chu kì, nhóm) của X trong bảng tuần hoàn là?








