Bộ 5 đề thi giữa kì Hóa 10 Kết nối tri thức (2023-2024) có đáp án - Đề 1
31 câu hỏi
Trong nguyên tử, hạt nào không mang điện?
Electron.
Proton.
neutron.
Proton và neutron.
Trong hạt nhân nguyên tử, hạt mang điện là
neutron.
proton và neutron.
proton.
electron và proton.
Thành phần cấu tạo nên lớp vỏ nguyên tử là
electron.
neutron.
proton.
proton và neutron.
Lớp vỏ của nguyên tử nguyên tố X có 11 electron (Biết qe = – 1,602.10–19C). Điện tích hạt nhân nguyên tử X là
– 1,76,10–18C.
+1.826,10–18C.
+ 1,76,10–18C.
– 1.826.10–18C.
Nguyên tử Copper (Cu ) có số hiệu nguyên tử là
35.
93.
29.
63.
Số hiệu nguyên tử cho biết thông tin nào sau đây?
số proton.
số neutron.
số khối.
nguyên tử khối.
Cho các kí hiệu nguyên tử sau: Z, T, Q, M. Các nguyên tử thuộc cùng một nguyên tố là:
Z và T.
Z và M.
Q và M.
Z và Q.
Fluorine và hợp chất của nó được sử dụng làm chất chống sâu răng, chất cách điện, chất làm vật liệu chống dính, .... Nguyên tử fluorine chứa 9 electron và có số khối là 19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
28.
30.
19.
32.
Cho các nhận định sau:
(a) Nguyên tố hóa học là tập hợp các nguyên tử có cùng số neutron.
(b) Đồng vị của nguyên tố là những nguyên tử có cùng số proton nhưng có số neutron khác nhau.
(c) Tất cả những nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là nguyên tố kim loại.
(d) Trong nguyên tử, hạt electron có khối lượng không đáng kể so với hạt proton và hạt neutron.
Số nhận định không đúngng là
1.
2.
3.
4.
Số electron tối đa trên phân lớp d là
14.
10.
2.
6.
Lớp electron nào sau đây gần hạt nhân nhất?
L.
N.
K.
M.
Cấu hình electron của nguyên tử P (Z = 15) là
1s22s22p63s23p6.
1s22s22p63s23p4.
1s22s22p63s23p5.
1s22s22p63s23p3.
Cho cấu hình electron của Fe 1s22s22p63s23p63d64s2. Fe thuộc loại nguyên tố nào?
Nguyên tố p.
Nguyên tố f.
Nguyên tố s.
Nguyên tố d .
Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng cũng là 6. X là nguyên tố hóa học nào sau đây?
sulfur.
Iron.
Chromium.
Oxygen.
Hình vẽ dưới đây cho biết hình dạng của orbital
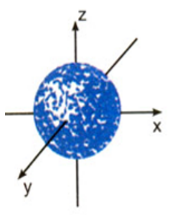
p.
d .
f.
s.
Biểu diễn sự sắp xếp electron trong nguyên tử oxygen (Z =8) theo orbital ở lớp ngoài cùng nào sau đây là đúng?
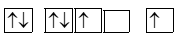
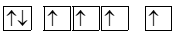
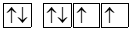
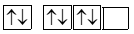
Nguyên tố X tham gia vào hơn 300 phản ứng sinh học và là vi chất quan trọng thứ 4 trong cơ thể con người. Vai trò chính của X là hoạt động như một đồng phân hoặc “phân tử trợ giúp" trong các phản ứng sinh hóa liên tục được thực hiện bởi các enzyme. Nguyên tử của nguyên tố X có 3 lớp electron, trên lớp 3 chứa 2 electron. Cấu hình electron và tính chất của X là
1s22s22p63s2, phi kim.
1s22s22p63s2, kim loại.
1s22s22p63s23p2, phi kim.
1s22s22p63s23p6, khí hiếm.
Nguyên tử Calcium có kí hiệu là Ca. Phát biểu nào sau đây không đúng?
Calcium ở ô thứ 20 trong bảng tuần hoàn.
Số hiệu nguyên tử của Calcium là 20.
Tổng số hạt cơ bản của Calcium là 40.
Nguyên tử Calcium có 2 electron lớp ngoài cùng.
Cho cấu hình electron của các nguyên tố sau:
(a) 1s22s22p63s2;
(b) 1s22s22p63s23p64s1;
(c) 1s22s22p63s23p6;
(d) 1s22s22p63s23p63d64s2.
Các nguyên tố kim loại là trường hợp nào sau đây?
(a), (c), (d).
(b), (c), (d).
(a), (b), (c).
(a), (b), (d).
Chu kì là dãy các nguyên tố được xếp theo chiều điện tích hạt nhân tăng dần, nguyên tử của chúng có cùng
số electron.
số lớp electron.
số electron ở lớp ngoài cùng.
số electron hóa trị.
Trong bảng tuần hoàn, có bao nhiêu chu kì?
4.
5.
6.
7.
Bảng tuần hoàn hiện nay có số cột, số nhóm A và số nhóm B lần lượt là
18, 8, 8.
18, 8, 10.
18, 10, 8.
16, 8, 8.
Trong bảng tuần hoàn, nhóm các nguyên tố kim loại điển hình là
IVA.
VIA.
IIIA.
IA.
Cho cấu hình electron nguyên tử của X là 1s22s22p63s23p64s1. Vị trí của X trong bảng tuần hoàn là
Ô số 19, chu kì 4, nhóm IA.
Ô số 19, chu kì 4, nhóm IB.
Ô số 19, chu kì 4, nhóm IIA.
Ô số 19, chu kì 4, nhóm IVA.
Silicon là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử. Ngoài ra, nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện để cung cấp cho các thiết bị trên tàu vũ trụ.
Vị trí của nguyên tố silicon (Z = 14) trong bảng tuần hoàn là
chu kì 3, nhóm IVA.
chu kì 3, nhóm IVB.
chu kì 4, nhóm IIA.
chu kì 3, nhóm IIB.
Trong nguyên tử của các nguyên tố nhóm IIA có bao nhiêu electron lớp ngoài cùng?
8.
7.
1.
2.
Nguyên tố X ở chu kì 3, nhóm IIIA. Cấu hình electron nguyên tử của nguyên tố X là
1s22s22p63s23p1.
1s22s22p3.
1s22s22p5.
1s22s22p63s23p3.
Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì
tính phi kim giảm dần, bán kính nguyên tử tăng dần.
tính kim loại tăng dần, độ âm điện tăng dần.
độ âm điện giảm dần, tính phi kim tăng dần.
tính kim loại tăng dần, bán kinh nguyên tử giảm dần.
(1,0 điểm) Cho thông tin của Phosphorus như sau:

(a) Viết cấu hình electron, từ đó xác định vị trí của P (số thứ tự ô nguyên tố, chu ki và nhóm) trong bảng tuần hoàn. Giải thích?
(b) Xác định tính chất hóa học cơ bản của nguyên tố P (tính kim loại, phi kim, khi hiếm).Vì sao?
(1,0 điểm) Hợp kim chứa nguyên tố X nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố X còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng. Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12.
Xác định số hạt proton, electron, neutron trong X và viết kí hiệu nguyên tử của X.
(1,0 điểm) Trong tự nhiên, Copper có hai đồng vị là Cu và Cu, trong đó đồng vị Cu chiếm 27% về số nguyên tử.
(a) Tính nguyên tử khối trung bình của Copper (Cu).
(b) Tính trăm khối lượng của Cu trong CuCl2 (Cho Cl=35,5).








