Bộ 5 đề thi giữa kì 1 Hóa 11 Cánh diều (2023-2024) có đáp án - Đề 5
23 câu hỏi
Yếu tố nào sau đây luôn luôn không làm dịch chuyển cân bằng của hệ phản ứng?
Chất xúc tác
Áp suất
Nồng độ
Nhiệt độ
Công thức nào sau đây viết sai?
pH = -lg[H+].
[H+] = 10-pH.
[H+].[OH-] = 10-14.
pH = -lg[OH-].
Giá trị hằng số cân bằng KC của phản ứng thay đổi khi
thay đổi áp suất.
thêm chất xúc tác.
thay đổi nồng độ các chất.
thay đổi nhiệt độ.
Phản ứng thuận nghịch là phản ứng
luôn có nồng độ chất phản ứng bằng nồng độ sản phẩm.
xảy ra hoàn toàn
xảy ra chậm
xảy ra theo hai chiều ngược nhau trong cùng điều kiện
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vài trò là
acid.
base.
chất khử.
chất oxi hóa.
Dung dịch chất nào sau đây làm xanh quỳ tím?
NaOH.
KCl.
HCl.
Na2SO4.
Muối nào sau đây kém bền nhiệt và dễ bị phân hủy khi nung nóng?
NaCl.
BaSO4.
NH4Cl.
Fe(OH)3.
Theo thuyết của Bronsted – Lowry thì acid là chất
nhận proton.
tan trong nước phân li ra OH-.
cho proton.
tan trong nước phân li ra H+.
Trong ammonia, nitrogen có số oxi hóa là
+3.
-3.
+4.
+5.
Dung dịch nào sau đây có pH < 7?
KOH.
HNO3.
Na2SO4.
BaCl2.
Phương trình mô tả sự điện li của NaCl trong nước là
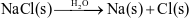
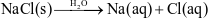
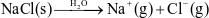
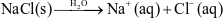
Số nguyên tử nitrogen trong một phân tử nitric acid là
1.
2.
4.
3.
Chất nào sau đây là chất điện li?
6H12O6.
HNO3.
MgO.
CH4.
Trong tự nhiên, đơn chất nitrogen có nhiều trong
mỏ khoáng.
nước biển.
không khí.
cơ thể người.
Kim loại nào sau đây không tác dụng với nitric acid?
Au.
Cu.
Ag.
Zn.
Mối quan hệ giữa tốc độ phản ứng thuận (vt) và tốc độ phản ứng nghịch (vn) ở trạng thái cân bằng được biểu diễn như thế nào?
vt = vn = 0.
vt = 2vn.
vt = vn 0.
vt = 0,5vn.
Cho sơ đồ chuyển hóa nitrogen trong khí quyển thành phân đạm:
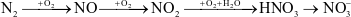
Số phản ứng thuộc loại oxi hóa – khử trong sơ đồ là
4.
2.
3.
1.
Cho cân bằng hoá học: PCl5 (g)  PCl3 (g) + Cl2 (g);
PCl3 (g) + Cl2 (g); 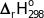 > 0.
> 0.
Cân bằng chuyển dịch theo chiều thuận khi
tăng áp suất của hệ phản ứng.
tăng nhiệt độ của hệ phản ứng.
thêm Cl2 vào hệ phản ứng.
thêm PCl3 vào hệ phản ứng.
Trong số các dung dịch có cùng nồng độ 0,1 M dưới đây, dung dịch chất nào có giá trị pH nhỏ nhất?
2SO4.
Ba(OH)2.
NaOH.
HCl.
Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
9.
10.
11.
8.
(2 điểm)
(1) Cho các chất sau: H2SO4, CH3COOH, NaOH, NH4Cl
(a) Xác định chất điện li mạnh, chất điện li yếu.
(b) Viết phương trình điện li của các chất trên.
(2) Viết công thức cấu tạo của N2, NH3, HNO3 và NH4+.
(2 điểm)
(1) Cho cân bằng: CH3COONa + H2O CH3COOH + NaOH
Tiến hành thí nghiệm sau:
- Cho khoảng 6 mL dung dịch CH3COONa 0,5M vào cốc thủy tinh, thêm 1 – 2 giọt phenolphathalein, khuấy đều, dung dịch có màu hồng nhạt.
- Chia dung dịch thu được vào 2 ống nghiệm. Ống nghiệm (1) ngâm trong cốc nước nóng, ống nghiệm (2) thêm vài giọt dung dịch CH3COOH.
Hãy cho biết màu của dung dịch trong các ống nghiệm (1), (2) thay đổi như thế nào? Giải thích.
(2) Hoàn thành các phương trình hóa học sau
(a) N2 + H2
(b) NH3 + O2
(c) NH4HCO3 (d) Cu + HNO3 loãng
(1 điểm)
(a) Sử dụng kiến thức hóa học để giải thích câu ca dao sau:
“Lúa chiêm lấp ló đầu bờ
Hễ nghe tiếng sấm, phất cờ mà lên”
(b) Vì sao người ta không sử dụng dung dịch acid HNO3 trong phương pháp chuẩn độ acid – base?








