Bộ 3 đề thi giữa kì 1 Hóa 11 Cánh diều cấu trúc mới có đáp án - Đề 2
28 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Phản ứng nào sau đây là phản ứng thuận nghịch ?
N2 + 3H2 ⇌ 2NH3.
Fe + 2HCl ⟶ FeCl2 + H2.
H2 + Cl2 ⟶ 2HCl.
2H2 + O2 ⟶ 2H2O.
Yếu tố nào sau đây không ảnh hưởng đến cân bằng hóa học?
(1) nồng độ; (2) nhiệt độ; (3) chất xúc tác; (4) áp suất; (5) diện tích bề mặt.
(1), (2), (4).
(3), (4).
(3), (5).
(2), (3), (5).
Cho phản ứng hoá học sau:
3Fe(s) + 4H2O(g) Fe3O4(s) + 4H2(g)
Biểu thức hằng số cân bằng của phản ứng trên là
\[{K_C} = \frac{{{{\left[ {{H_2}} \right]}^4}\left[ {F{e_3}{O_4}} \right]}}{{{{\left[ {{H_2}O} \right]}^4}{{\left[ {Fe} \right]}^3}}}\]
\[{K_C} = \frac{{{{\left[ {{H_2}} \right]}^4}}}{{{{\left[ {{H_2}O} \right]}^4}}}\]
\[{K_C} = \frac{{4\left[ {{H_2}} \right]}}{{4\left[ {{H_2}O} \right]}}\]
\[{K_C} = \frac{{4\left[ {{H_2}} \right]\left[ {F{e_3}{O_4}} \right]}}{{4\left[ {{H_2}O} \right]3\left[ {Fe} \right]}}\]
Cho cân bằng sau trong bình kín: 2NO2 (màu nâu đỏ)N2O4 (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có:
ΔH < 0, phản ứng toả nhiệt.
ΔH > 0, phản ứng toả nhiệt.
ΔH < 0, phản ứng thu nhiệt.
ΔH > 0, phản ứng thu nhiệt.
Sự điện li là
quá trình phân huỷ các chất thành chất mới khi hoà tan vào nước.
quá trình kết hợp giữa các ion thành phân tử trong dung dịch.
quá trình phản ứng giữa các ion tạo ra chất kết tủa.
quá trình phân li thành ion của các chất tan khi tan vào nước.
Chất nào sau đây không phải là chất điện li?
MgO.
KCl.
H2SO4.
KOH.
Theo thuyết của Bronsted – Lowry thì base là chất
cho proton.
tan trong nước phân li ra H+.
nhận proton.
tan trong nước phân li ra OH−.
Xét phản ứng giữa methanoic acid và nước:
HCOOH + H2O ⇌ HCOO– + H3O+
Cặp nào sau đây là acid theo Brønsted–Lowry?
H2O, HCOOH.
HCOOH, H3O+.
H2O, H3O+.
HCOOH, HCOO–.
“Đất phèn” là một khái niệm dân gian để chỉ loại đất chứa nhiều ion sulfate, có pH < 7. Môi trường của đất phèn là
môi trường base.
môi trường trung tính.
môi trường acid.
môi trường trung hoà.
Nồng độ mol/L của dung dịch HNO3 có pH = 3 là
3 (M).
−3 (M).
10−3(M).
− lg3 (M).
Trong tự nhiên, nguyên tố nitrogen (N) tồn tại ở dạng
đơn chất và hợp chất.
đơn chất.
hợp chất hữu cơ.
hợp chất vô cơ.
Lí do khí nitrogen được bơm vào các gói bim bim (snack) là
tạo môi trường trơ bảo quản bim bim.
diệt khuẩn để bảo quản bim bim lâu hơn.
tăng khối lượng cho gói bim bim.
tăng tính thẩm mĩ của gói bim bim.
Công thức Lewis của NH3 là
A. 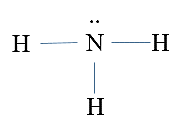
B. 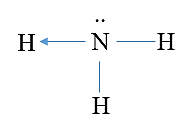
Phân tử nào sau đây có liên kết cho – nhận?
NH3.
N2.
HNO3.
H2.
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
màu hồng.
màu vàng.
màu đỏ.
màu xanh.
Vai trò của NH3 trong phản ứng oxi hoá – khử là
tính khử.
tính oxi hóa.
tính base.
tính acid.
Quá trình đốt cháy hỗn hợp hơi nhiên liệu và không khí trong động cơ khi đánh tia lửa điện sinh ra khí NO, một tác nhân gây ô nhiễm không khí. Tên gọi của NO là
Ammonia.
Nitrogen dioxide.
Nitrogen monoxide.
Nitrogen.
HNO3 thể hiện tính acid khi tác dụng với các chất thuộc dãy nào dưới đây?
CaCO3, Cu(OH)2, Fe(OH)2, FeO.
CuO, NaOH, FeCO3, Fe2O3.
Fe(OH)3, Na2CO3, Fe2O3, NH3.
KOH, FeS, K2CO3, Cu(OH)2.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Nitric acid (HNO3) là một chất lỏng, không màu, có tính acid mạnh và tính oxi hoá mạnh.
a. Dung dịch HNO3 làm xanh quỳ tím và làm phenolphtalein hóa hồng.
b. Nitric acid được dùng để sản xuất phân đạm, thuốc nổ (TNT), thuốc nhuộm, dược phẩm.
c. Trong công nghiệp, để sản xuất HNO3 người ta đun hỗn hợp NaNO3 hoặc KNO3 rắn với H2SO4 đặc.
d. Điều chế HNO3 trong phòng thí nghiệm người ta dùng khí ammonia (NH3).
Cho phương trình hoá học của phản ứng nung vôi:
CaCO3(s) ⇌ CaO(s) + CO2(g)
a. Để thu được nhiều vôi sống hơn, cần phải làm cân bằng chuyển dịch theo chiều thuận.
b. Tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch.
c. Phản ứng thuận là phản ứng toả nhiệt.
d. Thiết kế để khí CO2 thoát ra khỏi lò nung nhanh hơn giúp cân bằng chuyển dịch theo chiều thuận.
Chất điện li là chất khi tan trong nước phân li ra ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
a. Acid mạnh, base mạnh là các chất điện li mạnh.
b. KNO3, KOH, HCl là các chất điện li mạnh.
c. C2H5OH là chất điện li yếu.
d. CH3COOH là chất không điện li.
Phân tử nitrogen có liên kết ba giữa hai nguyên tử nitrogen.
a. Liên kết ba giữa hai nguyên tử nitrogen có năng lượng liên kết rất lớn.
b. Phản ứng của nitrogen và hydrogen là phản ứng một chiều.
c. Trong phản ứng với oxygen, nitrogen thể hiện tính khử.
d. Trong phòng thí nghiệm, có thể thu khí nitrogen bằng phương pháp đẩy nước.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Cho cân bằng hoá học sau:
2SO2(g) + O2(g) 2SO3(g) \[{\Delta _r}H_{298}^o < 0\]
Cho các tác động: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những tác động nào làm cân bằng chuyển dịch theo chiều nghịch?
Quá trình thuỷ phân ion \[CO_3^{2 - }\]trong nước làm pH của dung dịch thay đổi như thế nào?
Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất tổng hợp NH3, cần điều chỉnh áp suất như thế nào?
Trong phản ứng của nitrogen với oxygen, đơn chất nitrogen đóng vai trò là?
Cho các chất: KNO3, HCl, HClO, H2S, Cu(OH)2, Ba(OH)2, NaHCO3. Có bao nhiêu chất điện li mạnh trong các chất trên?
Cho sơ đồ phản ứng: FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O. Sau khi cân bằng, tổng hệ số cân bằng (nguyên, tối giản) của các chất trong phản ứng là?








