Bộ 5 đề thi giữa kì 1 Hóa 11 Cánh diều (2023-2024) có đáp án - Đề 2
31 câu hỏi
Phản ứng nào sau đây là phản ứng thuận nghịch?
.
2SO2 + O2 ⇌ 2SO3.
2 H 5 O H + 3 O 2 → t o 2 C O 2 + 3 H 2 O .
Mối quan hệ giữa tốc độ phản ứng thuận (vt) và tốc độ phản ứng nghịch (vn) ở trạng thái cân bằng được biểu diễn như thế nào?
vt = 2vn.
vt = 3vn.
vt = 0,5vn.
vt = vn.
Các yếu tố ảnh hưởng đến cân bằng hóa học là
nồng độ, nhiệt độ và chất xúc tác.
nồng độ, áp suất và diện tích bề mặt.
nồng độ, nhiệt độ và áp suất.
áp suất, nhiệt độ và chất xúc tác.
Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD. Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng được xác định theo biểu thức:
K C = [ A ] . [ B ] [ C ] . [ D ]
K C = [ A ] a . [ B ] b [ C ] c . [ D ] d
K C = [ C ] c . [ D ] d [ A ] a . [ B ] b
K C = [ C ] . [ D ] [ A ] . [ B ]
Biểu thức tính hằng số cân bằng của phản ứng thuận nghịch: H2 (g) + I2 (g) 2HI(g) là
Cho cân bằng hóa học sau: CaCO3(s) CaO(s) + CO2(g) ∆rH2980 = 176 kJ
Yếu tố nào sau đây làm cho cân bằng dịch chuyển theo chiều thuận?
Tăng nồng độ khí CO2.
Tăng áp suất.
Giảm nhiệt độ.
Tăng nhiệt độ.
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
ion trái dấu.
anion (ion âm).
cation (ion dương).
chất.
Trường hợp nào sau đây dẫn điện được?
KCl rắn, khan.
Glucose tan trong nước.
CaCl2 rắn, khan.
HBr hòa tan trong nước.
Chất nào sau đây thuộc loại chất điện li mạnh?
NaCl.
2S.
CH3COOH.
2H5OH.
Dung dịch nào sau đây có pH >7?
KOH.
CH3COOH.
HNO3.
HCl.
Theo thuyết của Bronsted – Lowry thì acid là chất
cho proton.
tan trong nước phân li ra H+.
nhận proton.
tan trong nước phân li ra OH-.
Công thức tính pH
pH = -lg[H+]
pH = lg[H+]
pH = +10 lg[H+]
pH = -lg[OH-]
Dung dịch Ba(OH)2 0,005 M có pH là
3
12
2
10
Một mẫu đất nông nghiệp được xử lý sau đó dùng máy pH đo được giá trị pH = 4,52. Để làm tăng độ pH của mẫu đất trên cần bón thêm cho đất một lượng hoá chất nào sau đây?
(NH4)2SO4.
CaO.
KCl.
NH4NO3
Cho các chất: NH3, HCl, H3PO4, Ba(OH)2. Theo thuyết Bronsted – Lowry có bao nhiêu chất trong dãy trên là base?
3.
4.
5.
2.
Ở điều kiện thường, nitrogen là chất
lỏng.
rắn.
khí.
lỏng hoặc rắn
Trong thực tiễn, nitrogen được ứng dụng để
tổng hợp ammonia, bảo quản thực phẩm.
sản xuất sulfuric acid.
trực tiếp sản xuất thuốc nổ trinitrotoluene(TNT).
Làm chất đánh sạch bề mặt kim loại.
Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do
nitrogen có bán kính nguyên tử nhỏ.
nitrogen có độ âm điện lớn.
phân tử nitrogen có liên kết ba bền vững.
phân tử nitrogen không phân cực.
Trong công thức Lewis của phân tử NH3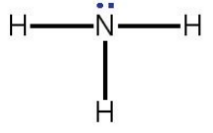
Nguyên tử hydrogen còn có một electron không liên kết.
Nguyên tử nitrogen còn có một electron không liên kết.
Nguyên tử nitrogen còn có một cặp electron không liên kết.
Liên kết N-H kém bền.
Để nhận biết ion NH4+ trong dung dịch, thuốc thử cần dùng là
dung dịch H2SO4.
dung dịch NaOH.
dung dịch NaNO3.
dung dịch NH3.
Trong ammonia, nitrogen có số oxi hóa là
+3.
-3.
+4.
+5.
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
màu hồng.
màu vàng.
màu đỏ.
màu xanh.
Các muối nào sau đây nhiệt phân cho sản phẩm khí NH3?
NH4HCO3, NH4NO2.
NH4NO3, NH4NO2.
NH4NO3, NH4HCO3.
NH4HCO3, NH4Cl.
Nguyên tố nitrogen tạo được với oxygen hợp chất có công thức là NO. Tên gọi của NO là?
Nitrogen dioxide
Nitrogen monooxide
Dinitrogen oxide
Dinitrogen tetroxide
Trong phân tử HNO3,nguyên tử N có số oxi hóa là
+5
+3
+4
-3
Nguyên nhân chủ yếu gây ra hiện tượng mưa acid là do khí và khí nào sau đây?
O 2
Nitric acid thể hiện tính oxi hóa khi phản ứng với chất nào sau đây?
KOH.
Cu.
NaOH.
CaCO3.
(1 điểm) Cho cân bằng sau trong bình kín:
2NO2 (g) N2O4 (g)
màu nâu đỏ không màu
Hãy cho biết sự biến đổi màu sắc của bình kín đựng khí NO2 trong các trường hợp sau và giải thích?
(a) Ngâm bình vào cốc nước nóng.
(b) Nén hỗn hợp khí để tăng áp suất của hệ.
(1 điểm) Hiện tượng phú dưỡng là gì? Em hãy cho biết nguyên nhân và tác hại của hiện tượng phú dưỡng.
(1 điểm) Trộn 250ml dung dịch gồm 0,10M và 0,01M với 250ml dung dịch KOH xM thu được 500ml dung dịch có pH = 2. Xác định giá trị của x.
Cho cân bằng hóa học sau: N2(g) + 3H2(g) 2NH3(g) có
![]() < 0. Cân bằng trên chuyển dịch theo chiều thuận khi
< 0. Cân bằng trên chuyển dịch theo chiều thuận khi
tăng nhiệt độ của hệ phản ứng.
giảm áp suất của hệ phản ứng.
tăng áp suất của hệ phản ứng.
thêm chất xúc tác vào hệ phản ứng.








