Bộ 5 đề thi giữa kì 1 Hóa 11 Cánh diều (2023-2024) có đáp án - Đề 3
31 câu hỏi
Các dung dịch NaCl, NaOH, NH3, Ba(OH)2 có cùng nồng độ mol, dung dịch có pH lớn nhất là
Ba(OH)2.
NH3.
NaCl.
NaOH.
Theo thuyết Bronsted-Lowry thì nhận xét nào sau đây là đúng ?
Axit hoặc bazơ không thể là ion.
Trong thành phần của bazơ phải có nhóm OH.
Axit hoặc bazơ có thể là phân tử hoặc ion.
Trong thành phần của axit phải có hiđro.
Phương trình điện li nào viết không đúng?
NaCl → Na+ + Cl-.
HClO ⇄ H+ + ClO-.
Ba(OH)2 ⇄Ba2+ + 2OH-.
Al2(SO4)3 → 2Al3++ 3SO42-.
Dãy chất nào dưới đây chỉ gồm những chất điện li mạnh ?
HNO3, Cu(NO3)2, H3PO4, Ca(NO3)2.
CaCl2, CuSO4, H2S, HNO3.
2SO4, NaCl, KNO3, Ba(NO3)2.
KCl, H2SO4, H2O, MgCl2.
Cho sơ đồ phản ứng : C + HNO3 (đ) CO2 + NO2 + H2O. Tổng hệ số cân bằng của phản ứng là
13
10
11
12
Phát biểu không đúng là
Phân tử NH3 chứa các liên kết cộng hóa trị không phân cực.
Khí NH3 tan nhiều trong nước.
Trong điều kiện thường, NH3 là khí không màu, mùi khai.
Khí NH3 nhẹ hơn không khí.
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng, đó là
hơi nước.
NH3.
HCl
NH4Cl.
Trong những nhận xét dưới đây, nhận xét nào là đúng khi nói về nitrogen?
Số oxi hóa của nitrogen trong các hợp chất và ion AlN, N2O4, NH4+, NO3-, NO2-, lần lượt là -3, +4, -3,+5,+4.
Nitrogen không duy trì sự cháy, sự hô hấp và là một khí độc.
Vì có liên kết 3 nên phân tử nitrogen rất bền và ở nhiệt độ thường nitrogen khá trơ về mặt hóa học.
Khi tác dụng với khí hydrogen, nitrogen thể hiện tính khử.
Cho các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl. Các chất điện li yếu là
K3PO4, H2SO4.
NH4Cl, HNO2.
HClO, H2SO4.
HClO, HNO2.
Trong các phản ứng dưới đây, phản ứng nào NH3 thể hiện tính base?
4NH3 + 5O2 → 4NO + 6H2O.
2NH3 + 3CuO → 3Cu + N2 + 3H2O.
NH3 + CO2 + H2O → NH4HCO3.
8NH3 + 3Cl2 → 6NH4Cl + N2.
Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 12,395 lít (đkc) NO2 (sản phẩm khử duy nhất). Giá trị của m là
8 gam.
25,6 gam.
16 gam.
2,56 gam.
Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hoà trong nước). Hai tác nhân chính gây mưa acid là
l 2 , H C l .
.
.
.
Các yếu tố ảnh hưởng đến cân bằng hoá học là
nồng độ, áp suất và diện tích bề mặt.
áp suất, nhiệt độ và chất xúc tác.
nồng độ, nhiệt độ và chất xúc tác.
nồng độ, nhiệt độ và áp suất.
Cho các phản ứng:
(1) H2(g) + I2(g) 2HI(g) (2) 2SO2(g) + O2(g) 2SO3(g)
(3) 3H2(g) + N2(g) 2NH3(g) (4) N2O4(g) 2NO2(g)
Các phản ứng chuyển dịch theo chiều nghịch khi ta giảm áp suất của hệ là
(2), (3).
(2), (4).
(3), (4).
(1), (2).
Ứng dụng nào không phải của HNO3?
Sản xuất khí NO2 và N2H4.
Sản xuất thuốc nhuộm.
Sản xuất phân bón.
Sản xuất thuốc nổ.
Thí nghiệm với dd HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, biện pháp hiệu quả nhất là người ta nút ống nghiệm bằng:
Bông có tẩm nước
Bông có tẩm nước vôi
Bông có tẩm giấm ăn
Bông khô
Cho hệ cân bằng trong một bình kín: N2 (g) + O2 (g) 2NO (g);
Cân bằng trên chuyển dịch theo chiều nghịch khi
tăng nồng độ NO.
tăng áp suất của hệ.
Thêm khí N2 vào hệ.
tăng nhiệt độ của hệ.
Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2 .Hiện tượng xảy ra là
có kết tủa trắng
có khí mùi khai bay lên
Có kết tủa trắng và có khí mùi khai bay lên.
Không có hiện tượng
Trong tự nhiên, nitrogen tồn tại ở dạng nào ?
Đơn chất.
Hợp chất.
Ion.
Cả đơn chất và hợp chất.
Cân bằng hoá học
là một cân bằng tĩnh vì khi đó, các phản ứng thuận và phản ứng nghịch đều dừng lại.
là một trạng thái cân bằng động vì khi hệ đạt cân bằng hoá học, các phản ứng thuận và phản ứng nghịch vẫn tiếp tục xảy ra nhưng với tốc độ không bằng nhau.
là một trạng thái cân bằng động vì khi hệ đạt cân bằng hoá học, các phản ứng thuận và phản ứng nghịch vẫn tiếp tục xảy ra với tốc độ bằng nhau.
là một trạng thái cân bằng động vì khi hệ đạt cân bằng hoá học, phản ứng thuận dừng lại còn phản ứng nghịch vẫn tiếp tục xảy ra.
Giá trị pH của dung dịch NaOH 0,0001M là
11.
12.
10.
4.
Cho hai hệ cân bằng sau trong hai bình kín:
C (s) + CO2 (g) 2CO (g); = 172 kJ; (I)
CO (g) + H2O (g) CO2 (g) + H2 (g); = – 41 kJ(II)
Có bao nhiêu điều kiện trong các điều kiện sau đây làm các cân bằng trên chuyển dịch ngược chiều nhau (giữ nguyên các điều kiện khác)?
(1) Tăng nhiệt độ. (2) Thêm khí CO2 vào. (3) Tăng áp suất.
(4) Dùng chất xúc tác. (5) Thêm khí CO vào.
4.
5.
2.
3.
Cho dãy các chất: FeO, Fe(OH)2, FeSO4, Fe3O4, Fe2(SO4)3, Fe2O3. Số chất trong dãy bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là
4
6.
3.
5.
Theo thuyết Bronsted – Lowry chất nào sau đây lưỡng tính?
HCl.
O 3 2 − .
C O 3 − .
NaOH.
Theo thuyết Bronsted – Lowry chất nào sau đây lưỡng tính?
HCl.
NaOH.
2SO4.
HS-.
Trong dung dịch Ba(OH)2 có pH = 12, nồng độ của dung dịch Ba(OH)2 là
0,005 M.
0, 0001 M.
0,0005 M.
0,00005 M.
Phản ứng nhiệt phân nào dưới đây không đúng?
NH4NO2 N2 +2H2O.
NH4Cl NH3 + HCl.
NH4HCO3 NH3 + H2O + CO2.
NH4NO3 NH3 +HNO3.
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein.
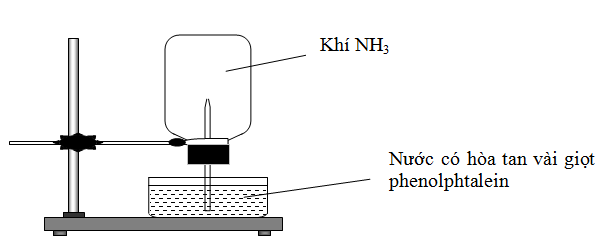
Hiện tượng xảy ra trong thí nghiệm là:
Nước phun vào bình và không có màu.
Nước phun vào bình và chuyển thành màu xanh
Nước phun vào bình và chuyển thành màu hồng.
Nước phun vào bình và chuyển thành màu tím.
(1,0 điểm) Cho 200ml dung dịch A chứa NaOH 0,05M
(a) Tính pH của dung dịch A?
(b) Thêm vào dung dịch A 200ml dung dịch HCl 0,25M. Tính pH của dung dịch thu được sau phản ứng?
(1 điểm)
Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hoá sau:
(a) Viết các phương trình hoá học xảy ra.
(b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của phản ứng sản xuất nitric acid theo sơ đồ trên là 96,2%.
(1 điểm) Hòa tan hoàn toàn 7,5 gam hỗn hợp gồm Mg và Al bằng lượng vừa đủ V lít dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 0,7437 lít N2 (ở đkc) duy nhất và dung dịch chứa 54,9 gam muối. Tìm V ?








