Bộ 3 đề thi giữa kì 1 Hóa 10 Kết nối tri thức có đáp án - Đề 2
32 câu hỏi
Mô hình cấu tạo của nguyên tử potassium (K) được biểu diễn như hình bên. Số hạt proton trong hạt nhân nguyên tử K là
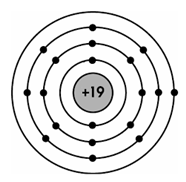
18.
19.
20.
17.
Các hạt cấu tạo nên hầu hết các nguyên tử là
electron và neutron.
electron, proton và neutron.
neutron và electron.
proton và neutron.
Trong nguyên tử, hạt mang điện là
proton và neutron.
electron.
electron và neutron.
proton và electron.
Hạt nhân nguyên tử Na có số proton là 11 và số neutron là 12. Số khối của hạt nhân nguyên tử neutron là
22.
24.
23.
11.
Số đơn vị điện tích hạt nhân nguyên tử (kí hiệu là Z) của một nguyên tố gọi là
số neutron.
nguyên tử khối.
số khối.
số hiệu nguyên tử.
Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về
số đơn vị điện tích hạt nhân.
số electron.
số neutron.
số nucleon.
Đồng vị là một đồng vị phóng xạ được sử dụng trong kĩ thuật chụp PET/CT để phát hiện tế bào ung thư. Số hạt neutron trong một nguyên tử là
10.
19.
18.
9.
Phát biểu nào sau đây không đúng?
Electron trên lớp K có năng lượng cao hơn trên lớp L.
Electron ở lớp K gần hạt nhân hơn so với electron ở lớp L.
Electron trên lớp M có năng lượng cao hơn trên lớp K.
Electron ở lớp M xa hạt nhân hơn so với electron ở lớp L.
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
1s22s22p63s23p3.
1s22s22p63s23p5.
1s22s22p53s23p4.
1s22s22p63s23p2.
Kí hiệu và số electron tối đa có trên lớp electron ứng với giá trị n = 3 tương ứng là
Lớp K và 8e.
Lớp K và 6e.
Lớp L và 8e.
Lớp M và 18e.
Hình dưới đây biểu diễn hình dạng của một orbital. Tên gọi của orbital này là
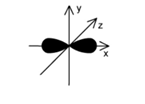
pz.
s.
px
py.
Số AO trong phân lớp 2p là
5.
1.
3.
7.
Phân lớp 3d có số electron tối đa là
6.
18.
14.
10.
Số chu kì trong bảng hệ thống tuần hoàn hiện tại là
8.
18.
7.
16.
Theo tiến trình lịch sử, ngày nay các nhà khoa học đã sắp xếp các nguyên tố hóa học trong bảng tuần hoàn dựa trên cơ sở
Theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Theo chiều tăng dần của khối lượng nguyên tử.
Theo chiều tăng dần số neutron.
Theo chiều tăng dần của số khối.
Trong bảng tuần hoàn, chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng
cấu hình electron.
số lớp electron.
số electron.
số electron lớp ngoài cùng.
Nếu phóng đại một nguyên tử vàng lên 1 tỉ (109) lần thì kích thước của nó tương đương một quả rổ (có đường kính 30 cm) và kích thước của hạt nhân tương đương một hạt cát (có đường kính 0,003cm). Tỉ lệ kích thước giữa nguyên tử vàng và hạt nhân là
10 000.
100.
1 000.
10.
Kim loại R là một thành phần quan trọng của khẩu phần dinh dưỡng. Sự thiếu hụt rất nhỏ của nó sẽ ảnh hưởng tới sự hình thành và phát triển của xương và răng. Hạt nhân nguyên tử R có điện tích +32.10-19 (C). Nguyên tố R có kí hiệu hóa học nào sau đây?
Al (Z = 13).
Na (Z = 11).
Ca (Z = 20).
K (Z = 19).
Nguyên tố M có trong một số loại trái cây, thực phẩm mà chúng ta nạp vào cơ thể hàng ngày. Chúng có tác dụng rất tốt cho việc cải thiện một số chức năng của não bộ và cấu trúc, mật độ xương. Nguyên tử của M có 12 electron, 12 neutron, kí hiệu nguyên tử của nguyên tố M là
Nguyên tử của nguyên tố M có 56 electron, trong hạt nhân có 81 neutron. Số khối của M là
56.
81.
86.
137.
Cấu hình e của là: 1s2 2s2 2p6 3s2 3p6 4s1. Vậy kết luận nào sau đây không đúng?
Có 20 neutron trong hạt nhân.
Là nguyên tố mở đầu chu kỳ 4.
Nguyên tử có 7e ở lớp ngoài cùng.
Thuộc chu kỳ 4, nhóm IA.
Phát biểu nào sau đây không đúng?
Năng lượng của electron trên lớp K (n = 1) là thấp nhất.
Lớp L (n = 2) có 4 orbital.
Phân lớp p có 3 orbital.
Lớp M (n = 3) có 9 phân lớp.
Nguyên tố Y được dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy. Cấu hình electron nguyên tử Y (Z = 16) ở trạng thái cơ bản là
1s22s22p63s23p3.
1s22s22p63s23p4.
1s22s22p63s23p2.
1s22s22p63s23p5.
Nguyên tố nào sau đây thuộc loại nguyên tố s?
1s22s22p5.
1s22s22p6.
1s22s22p63s2.
1s22s22p63s23p3.
Cấu hình electron nào sau đây là của kim loại?
1s22s22p63s23p3.
1s22s22p63s23p1.
1s22s22p63s23p5.
1s22s22p63s23p4.
Nguyên tử sulfur có cấu hình electron lớp ngoài cùng là 3s23p4. Vị trí (chu kì, nhóm) của nguyên tố sulfur trong bảng tuần hoàn là
chu kì 4, nhóm IIA.
chu kì 4, nhóm IIIA.
chu kì 3, nhóm VIA.
chu kì 3, nhóm IVA.
Số nguyên tố trong chu kì 3 của bảng tuần hoàn các nguyên tố hoá học là
32.
2.
8.
18.
Nguyên tử X có 15 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
chu kì 4.
chu kì 2.
chu kì 5.
chu kì 3.
(1 điểm): Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định thành phần các hạt cấu tạo nên nguyên tử X và cho biết X thuộc nhóm nào trong bảng tuần hoàn?
(1 điểm): Cho phổ khối của nguyên tố R như sau:
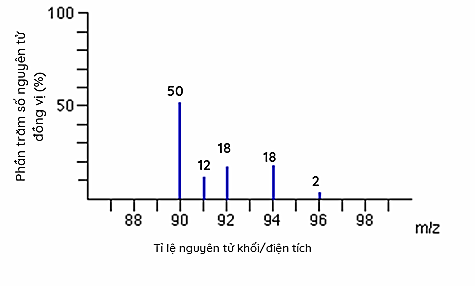
Tính nguyên tử khối trung bình của nguyên tố R.
(0,5 điểm): Trong tự nhiên nguyên tố copper (kí hiệu: Cu) có 2 đồng vị là và , trong đó đồng vị chiếm 27% về số nguyên tử. Tính phần trăm khối lượng của trong phân tử Cu2O (biết rằng nguyên tử khối của O bằng 16).
(0,5 điểm): Hai nguyên tố A và B thuộc cùng một nhóm chính (nhóm A) và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số hiệu nguyên tử của 2 nguyên tố A, B là 22. Xác định các nguyên tố A, B.








