Bộ 3 đề thi giữa kì 1 Hóa 10 Kết nối tri thức có đáp án - Đề 1
32 câu hỏi
Hạt nhân của hầu hết các nguyên tử đều tạo bởi hạt nào sau đây?
Electron và neutron.
Electron và proton.
Neutron và proton.
Neutron, proton và electron.
Trong nguyên tử, hạt không mang điện có tên gọi là
proton và electron.
proton.
electron.
neutron.
Miêu tả nào sau đây là đúng đối với proton?
Proton không mang điện tích và được tìm thấy bên ngoài hạt nhân.
Proton mang điện dương và tìm thấy ở ngoài hạt nhân.
Proton mang điện âm và được tìm thấy trong hạt nhân.
Proton mang điện dương và tìm thấy trong hạt nhân.
Nguyên tử nguyên tố fluorine có 9 proton, 9 electron và 10 neutron. Điện tích hạt nhân nguyên tử fluorine là
−10.
−9.
+9.
+10.
Cho các nguyên tử sau: ; ; ; ; ; . Các nguyên tử nào thuộc cùng một nguyên tố hoá học?
A và D, B và E.
B và E, C và F.
A và B, C và D.
A và C, B và D.
Số hiệu nguyên tử của nguyên tố hoá học bằng
số neutron của nguyên tử.
số khối.
số proton của nguyên tử.
số electron lớp ngoài cùng của nguyên tử.
Nguyên tử A có 12 electron, 12 neutron, kí hiệu nguyên tử của nguyên tố A là
.
.
.
.
Kí hiệu và số electron tối đa có trên lớp electron ứng với giá trị n = 2 tương ứng là
Lớp K và 6e.
Lớp L và 8e.
Lớp K và 8e.
Lớp L và 2e.
Sự phân bố electron theo ô orbital nào dưới đây là đúng?




Hình dưới đây biểu diễn hình dạng của một số orbital. Tên gọi lần lượt của các orbital tại hình 1, 2, 3 là
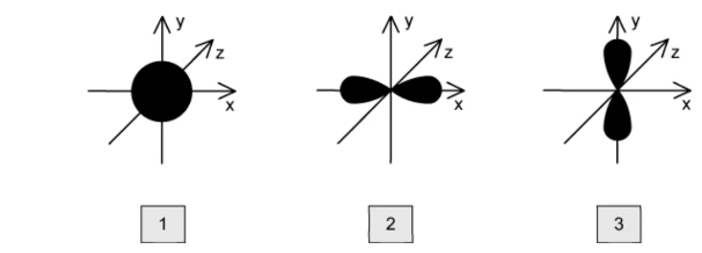
s, pz và py.
px, py và pz.
s, px và py.
s, px và pz.
Cấu hình electron của nguyên tử nitrogen (Z = 7) là
1s12s12p5.
1s22s22p4.
1s22s22p3.
1s22s32p4.
Số electron tối đa trong orbital p là bao nhiêu?
6.
3.
8.
2.
Số orbital trong các phân lớp s, p, d lần lượt bằng
1, 3, 5.
1, 2, 3.
1, 2, 4.
3, 5, 7.
Nguyên tử của các nguyên tố trong cùng một nhóm A (trừ He) có cùng
số electron.
số electron hoá trị.
Số lớp electron.
Số electron ở lớp ngoài cùng.
Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào sau đây?
Mỗi nguyên tố hoá học được xếp vào một ô trong bảng tuần hoàn.
Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
Các nguyên tố có cùng số lớp electron trên nguyên tử được xếp thành một hàng.
Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
chu kì.
ô nguyên tố.
nhóm.
bảng tuần hoàn.
Cho các phát biểu sau:
(1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân.
(2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(3) Số khối là khối lượng tuyệt đối của nguyên tử.
(4) Số proton bằng số đơn vị điện tích hạt nhân.
(5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số neutron.
Số phát biểu không đúng là
1.
4.
3.
2.
X là nguyên tố phổ biến thứ 4 trong vỏ trái đất, X có trong hemoglobin của máu làm nhiệm vụ vận chuyển oxygen, duy trì sự sống. Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.
(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là +26.
(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
4.
1.
3.
2.
Cho các phát biểu về nguyên tử :
(1) X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
(2) X có số hạt neutron nhiều hơn proton là 4.
(3) X có 4 lớp electron.
(4) Cấu hình electron của X là [Ar]3d44s2.
(5) X là kim loại.
Số phát biểu đúng là
4.
2.
3.
1.
Nguyên tử potassium (K) có 19 electron; 19 proton và 20 neutron. Số khối của nguyên tử potassium là
20.
19.
39.
58.
Lớp M có số phân lớp electron là
1.
2.
3.
4.
Nguyên tử của nguyên tố neon (Z = 10) có cấu hình electron là
1s22s22p63s2.
1s22s22p6.
1s22s22p63s1.
1s22s22p43s2.
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số electron độc thân là
1.
2.
0.
3.
Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử nguyên tố Y có một electron ở lớp ngoài cùng là 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X và Y lần lượt là
kim loại và kim loại.
phi kim và kim loại.
kim loại và khí hiếm.
khí hiếm và kim loại.
Cho cấu hình electron nguyên tử của các nguyên tố sau:
(X) 1s22s22p63s2; (Y) 1s22s22p63s23p64s1;
(Z) 1s22s22p63s23p3; (T) 1s22s22p63s23p63d84s2.
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
X, Z, T.
X, Y, T.
Y, Z, T.
X, Y, Z.
Nguyên tử X có cấu hình electron 1s22s22p63s23p3. X thuộc nhóm
IIIB.
VB.
VA.
IIIA.
Vị trí của nguyên tố có Z = 15 trong bảng tuần hoàn là
Chu kì 3, nhóm VA.
Chu kì 4, nhóm IIA.
Chu kì 4, nhóm VIB.
Chu kì 3, nhóm IIB.
Nguyên tử X có 22 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
4.
2.
5.
3.
(1 điểm): Fluorine và hợp chất của nó được sử dụng làm chất chống sâu răng, chất cách điện, chất làm lạnh, vật liệu chống dính,… Nguyên tử fluorine chứa 9 electron và có số khối là 19. Xác định thành phần các hạt cấu tạo nên hạt nhân nguyên tử fluorine.
(1 điểm): Xác định vị trí (ô, chu kì và nhóm) của các nguyên tố sau (có giải thích ngắn gọn cách xác định):
(a) Nguyên tố A có số hiệu nguyên tử là 19.
(b) Nguyên tố B có số đơn vị điện tích hạt nhân là 10.
(0,5 điểm): Trong tự nhiên chlorine có hai đồng vị bền: chiếm 24,23% tổng số nguyên tử, còn lại là . Tính phần trăm theo khối lượng của trong HClO4 (biết H = 1, O = 16).
(0,5 điểm): Nguyên tử của nguyên tố X có tổng số hạt là 52. Số hạt không mang điện gấp khoảng 1,06 lần số hạt mang điện âm. Xác định vị trí của X trong bảng tuần hoàn.








