Bộ 3 đề thi giữa kì 1 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
21 câu hỏi
A. Phần trắc nghiệm
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Các hạt cấu tạo nên hầu hết các nguyên tử là
electron và neutron.
electron, proton và neutron.
neutron và electron.
proton và neutron.
Trong nguyên tử, hạt mang điện tích dương là
neutron và proton.
proton.
electron.
neutron.
Nguyên tử nguyên tố potassium (K) có 19 proton và 20 neutron. Khối lượng gần đúng của nguyên tử K là (biết me = 0,00055 amu; mp = 1 amu; mn = 1 amu)
29,01 amu.
38,02 amu.
39,01 amu.
32,10 amu.
Chọn phát biểu đúng khi nói về nguyên tử \[{}_{12}^{24}Mg\] trong các phát biểu sau?
Mg có 12 electron.
Mg có 24 proton.
Mg có 24 electron.
Mg có 24 neutron.
X và Y là đồng vị của cùng một nguyên tố hóa học. Phát biểu nào sau đây đúng?
X và Y có cùng số hạt neutron và khác số hạt proton.
X và Y có cùng số hạt electron và khác số hạt proton.
X và Y có cùng số hạt proton và khác số hạt electron.
X và Y có cùng số hạt proton và khác số hạt neutron.
Trong tự nhiên hydrogen có 3 đồng vị: 1H, 2H, 3H. Oxygen có 3 đồng vị 16O, 17O, 18O. Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên?
3.
16.
18.
9.
Orbital có dạng hình cầu là
orbital s.
orbital p.
orbital f.
orbital d.
Nguyên tử sulfur (Z = 16) có cấu hình electron nguyên tử là
1s22s22p63s23p2.
1s22s22p6.
1s22s22p63s3 .
1s22s22p63s23p4.
Số electron tối đa trong lớp M là
8
18.
32.
2.
Trong bảng hệ thống tuần hoàn hiện tại các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là
3 và 3.
4 và 3.
3 và 4.
4 và 4.
Khi nói về chu kì, phát biểu nào sau đây không đúng?
Bảng tuần hoàn hiện tại có 7 chu kì.
Tất cả các chu kì mở đầu là một kim loại điển hình và kết thúc là một phi kim điển hình.
Trong một chu kì, các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
Trong cùng một chu kì, các nguyên tử có cùng số lớp electron.
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIIA trong bảng tuần hoàn các nguyên tố hóa học đều là
np3.
ns3.
ns2np1.
ns2np4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Xét đặc điểm của các hạt cơ bản: proton, neutron, electron.
a. Hạt proton có điện tích tương đối là +1 và khối lượng xấp xỉ 1 gam.
b. Hạt neutron không mang điện và khối lượng xấp xỉ 1 amu.
c. Hạt electron có điện tích tương đối là -1 và khối lượng là 0,00055 amu.
d. Trong nguyên tử khối lượng electron rất nhỏ so với khối lượng của proton và neutron nên khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân.
X là một trong những nguyên tố có mặt trong nước Javel – nước tẩy trắng quần áo, sợi vải. Y là một nguyên tố khoáng có ý nghĩa quan trọng đối với sự phát triển của hệ xương khớp. Anion X- và cation Y2+ đều có cấu hình e lớp ngoài cùng là 3s23p6.
a. Cấu hình electron của X là [Ar]4s1.
b. Cấu hình electron của Y là [Ar]4s2.
c. Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 1 electron độc thân.
d. Ở trạng thái cơ bản, nguyên tử của nguyên tố Y có 2 electron độc thân.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.Thí sinh trả lời từ câu 1 đến câu 4.
Nguyên tử nguyên tố fluorine có 9 proton, 9 electron và 10 neutron. Số đơn vị điện tích hạt nhân nguyên tử fluorine là?
Đáp án đúng là: ……………….
Nguyên tử X chứa 9 electron và có số khối là 19. Tổng số hạt proton, electron và neutron trong nguyên tử X là?
Đáp án đúng là: ……………….
Cấu hình electron của nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 9. Số electron lớp ngoài cùng của X là?
Đáp án đúng là: ……………….
Nguyên tử X có 25 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
Đáp án đúng là: ……………………
B. Phần tự luận
Cho phổ khối của nguyên tố R như sau:
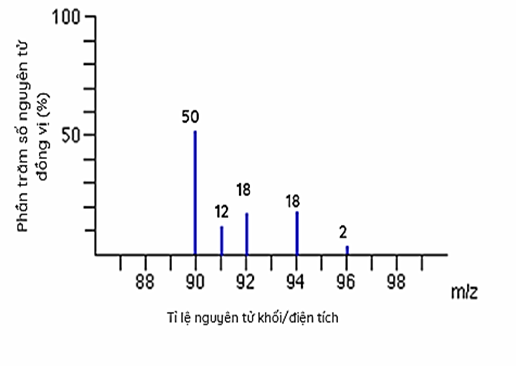
Tính nguyên tử khối trung bình của nguyên tố R.
Nguyên tử chromium ở ô số 24 trong bảng tuần hoàn. Cấu hình electron của nguyên tử chromium là?
Xác định vị trí (ô, chu kì và nhóm) của các nguyên tố sau (có giải thích ngắn gọn cách xác định):
a. Nguyên tố A có số hiệu nguyên tử là 19.
b. Nguyên tố B có số đơn vị điện tích hạt nhân là 10.








