40 CÂU HỎI
Cho các cặp chất sau:
(1) Khí F2và khí O2.
(2) Khí H2S và dung dịch FeCl3.
(3) Khí H2S và dung dịch Pb(NO3)2.
(4) CuS và cặp dung dịch HCl.
(5) Dung dịch AgNO3và dung dịch FeCl3.
(6) Dung dịch KMnO4và khí SO2.
(7) Hg và S.
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là:
A. 5.
B. 7.
C. 4.
D. 6.
Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng
A. quỳ tím.
B. dd muối Mg2+
C. thuốc thử duy nhất là Ba(OH)2
D. dd chứa ion Ba2+.
Hấp thụ hoàn toàn 5,6 lít khí SO2(đktc) vào 400 ml dung dịch NaOH 1M. Khối lượng muối thu được sau phản ứng là: (Cho Na = 23; S = 32; O = 16; H = 1)
A. 24,5 gam.
B. 18,9 gam.
C. 10,4 gam.
D. 29,3 gam.
Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. PbS.
B. H2S.
C. SO2.
D. K2SO4.
Các nguyên tố thuộc nhóm oxi - lưu huỳnh có bao nhiêu electron ở phân lớp ngoài cùng?
A. 1
B. 3
C. 4
D. 2
Liên kết trong các phân tử đơn chất halogen là gì?
A. cộng hóa trị có cực.
B. công hóa trị không cực.
C. liên kết ion.
D. liên kết cho nhận.
Anion X2-có cấu hình electron lớp ngoài cùng là 2s22p6. Nguyên tố X là
A. S.
B. O.
C. Cl.
D. F.
Cho FeS tác dụng với dung dịch HCl, khí bay ra là
A. Cl2.
B. H2S.
C. H2.
D. SO2.
Khi sục SO2vào dung dịch NaOH theo tỉ lệ \(\frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = 2\) thu được dung dịch
gồm các chất
A. NaHSO3, Na2SO3.\(\)
B. NaHSO3
C. Na2SO3.
D. Na2SO4.
Trong các nguyên tử nguyên tố nhóm halogen, chất ở trạng thái khí màu lục nhạt là
A. Iot.
B. Brom.
C. Clo.
D. Flo.
Phần trăm khối lượng của S có trong phân tử Fe2(SO4)3
A. 8%.
B. 24%.
C. 16%.
D. 28%.
Cho 11,2 gam bột Fe tác dụng với dung dịch HCl dư thu được V lít khí H2bay ra (đktc). Thể tích V lít khí thoát ra là?
A. 2,24.
B. 3,36.
C. 4,48.
D. 44,8.
Khí oxi không phản ứng được với
A. Cu.
B. S.
C. Fe.
D. Cl2.
Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3(dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 28,7.
B. 68,2.
C. 57,4.
D. 10,8.
Kim loại không phản ứng với axit H2SO4đặc, nguội là
A. Ag.
B. Fe.
C. Cu.
D. Zn.
Cho 15,8 gam KMnO4tác dụng hoàn toàn với dung dịch HCl đặc, dư. Thể tích khí thu được (đktc) là:
A. 5,6 lít.
B. 4,48 lít.
C. 8,96 lít.
D. 0,6 lít.
Các số oxi hoá có thể có của S trong hợp chất là
A. –2; +4; +6.
B. –2; +4; +6; 0.
C. +4; +6; 0.
D. -2; 0; +4.
Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. NaHCO3.
B. (NH4)2SO4.
C. KMnO4.
D. CaCO3.
Hoà tan 8,8 gam hỗn hợp X gồm Mg và Cu trong axit H2SO4loãng dư, sau khi phản ứng xảy ra thì thu được 4,48 lít khí H2(đktc). Số gam của Mg và Cu trong hỗn hợp X lần lượt là
A. 4,8 và 4.
B. 6,4 và 2,4.
C. 2,4 và 6,4.
D. 4 và 4,8.
Hợp chất của lưu huỳnh có tính tẩy màu là
A. H2SO4 loãng.
B. H2S.
C. SO2.
D. SO3.
Cho 2,24 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 22,4 gam CuX2. Nguyên tố halogen là
A. Clo.
B. Brom.
C. Flo.
D. Iot.
Để điều chế SO2trong công nghiệp người ta tiến hành như sau:
A. Đốt cháy S hoặc quặng pirit sắt (FeS2).
B. Cho kim loại phản ứng với H2SO4 đặc.
C. Cho dd Na2SO3+ ddH2SO4.
D. Cho Na2SO3tinh thể + ddH2SO4, đun nóng.
Nhiệt phân hoàn toàn 4,385 gam hỗn hợp X gồm KClO3và KMnO4 thu được O2và m gam hỗn hợp chất rắn. Toàn bộ lượng O2sinh ra tác dụng hết với cacbon nóng đỏ, thu được 0,896 lít hỗn hợp khí có tỉ khối so với hidro là 16. Phần trăm về khối lượng của KMnO4trong hỗn hợp đầu là
A. 73,85.
B. 75,76.
C. 79,18.
D. 72,06.
Để pha loãng dd H2SO4đậm đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào trong các cách sau đây:
A. Cho nhanh nước vào axit và khuấy đều.
B. Cho nhanh axit vào nước và khuấy đều.
C. Cho từ từ axit vào nước và khuấy đều.
D. Cho từ từ nước vào axit và khuấy đều.
Phản ứng mà SO2thể hiện tính khử là?
A. SO2+ 2H2S → 3S + 2H2O.
B. SO2+ 2NaOH → Na2SO3+ H2O.
C. SO2+ H2O ⇄ H2SO3.
D. 2SO2+ O2⇄ 2SO3.
Cấu hình e lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. ns2 np5.
B. ns2np3.
C. ns2np4.
D. ns2np6.
Phương pháp điều chế khí hidroclorua trong phòng thí nghiệm là
A. NaCl tinh thể và H2SO4 đặc.
B. Thủy phân AlCl3.
C. Clo tác dụng với H2O.
D. Tổng hợp từ H2và Cl2.
Trong các phản ứng sau, phản ứng nào thể hiện tính oxi hóa của lưu huỳnh đơn chất?
A. S + HNO3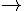 SO2+ NO2+ H2O.
SO2+ NO2+ H2O.
B. S + Hg 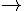 HgS.
HgS.
C. S + Na2SO3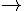 Na2S2O3.
Na2S2O3.
D. S + O2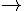 SO2.
SO2.
Oxi tác dụng với tất cả các chất trong nhóm nào dưới đây?
A. K, Mg, Cl2.
B. Na, I2, N2.
C. Mg, Al, N2.
D. Ca, Au, S.
Cho phương trình phản ứng Cu + H2SO4đ→ CuSO4+ SO2+ H2O.
Hệ số cân bằng tối giản nhất của H2SO4đlà?
A. 2.
B. 1.
C. 4.
D. 3.
Dãy nào sau đây được sắp xếp theo chiều tăng dần của tính phi kim?
A. F, Cl, Br, I.
B. Cl, Br, F, I.
C. Br, Cl, F, I.
D. I, Br, Cl, F.
Cho phản ứng: SO2 + Cl2 + 2H2O \( \to \) 2HCl + H2SO4. Clo là chất đóng vai trò chất
A. oxi hóa.
B. khử.
C. vừa oxi hóa, vừa khử.
D. không oxi hóa khử.
Nhóm kim loại nào sau đây không có phản ứng với H2SO4 loãng?
A. Zn, Al.
B. Mg, Cu.
C. Cu, Ag.
D. Ag, Fe.
Kim loại nào sau đây khi tác dụng với dung dịch HCl và khí clo đều cho cùng một loại muối
A. Hg.
B. Cu.
C. Mg.
D. Fe.
Trong phân tử H2S nguyên tử S có
A. số oxi hoá +6.
B. số oxi hoá +4.
C. số oxi hoá -2.
D. số oxi hoá +2.
Phản ứng chứng tỏ ozon có tính oxi hoá mạnh hơn oxi là
A. C2H5OH + 3O2→ 2CO2+ 3H2O.
B. 3C + 2O3→ 3CO2.
C. 2Ca + O2→ 2CaO.
D. 2Ag + O3→ Ag2O + O2.
Cho các chất: C, Cu, FeS, FeO, Fe(OH)2, Fe2O3, Fe(OH)3, NaCl rắn. Số chất tác dụng với H2SO4 đ, nóng tạo chất khí là
A. 5.
B. 4.
C. 6.
D. 7.
Công thức của clorua vôi là
A. CaO2Cl.
B. CaOCl2.
C. CaOCl.
D. Ca2OCl.
Axit không thể đựng trong bình thủy tinh là
A. HNO3.
B. H2SO4.
C. HCl.
D. HF.
Cho phản ứng 2Fe(OH)3+ 3H2SO4→ X + 6H2O. Tên X là?
A. Sắt (III) sunfit.
B. Sắt (III) sunfat.
C. Sắt (III) sunfua.
D. Sắt (III) sunfurơ.


