30 CÂU HỎI
Phát biểu nào sau đây khôngđúng?
A.Muối AgI không tan trong nước, muối AgF tan trong nước.
B.Dung dịch HF hòa tan được SiO2.
C.Trong các hợp chất, ngoài số oxi hóa -1, flo và clo còn có số oxi hóa +1, +3, +5, +7.
D.Flo có tính oxi hóa mạnh hơn clo.
Nhúng giấy quỳ tím vào dung dịch HCl, quỳ tím
A.hóa đỏ.
B.hóa xanh.
C.mất màu.
D.không đổi màu.
Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hóa?
A.Fe + 2HCl → FeCl2+ H2↑
B.NaOH + HCl → NaCl + H2O
C.Fe + KNO3+ 4HCl → FeCl3+ KCl + NO↑ + 2H2O
D.MnO2+ 4HCl → MnCl2+ Cl2↑ + 2H2O
Nguyên tố nào sau đây thuộc nhóm nguyên tố halogen?
A.S.
B.Cl.
C.O.
D.N.
Có thể nhận biết ion sunfat bằng
A.chất chỉ thị màu.
B.màu sắc của dung dịch.
C.dung dịch axit mạnh.
D.dung dịch muối bari hoặc dung dịch Ba(OH)2.
Chất dùng để làm khô khí Cl2ẩm là
A.dung dịch NaOH đặc.
B.CaO.
C.dung dịch NaCl.
D.dung dịch H2SO4đậm đặc.
Chọn câu đúng trong các câu sau?
A.Clorua vôi không phải là muối.
B.Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
C.Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
D.Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hoá trong phản ứng nào sau đây?
B.S + 3F2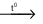 SF6
SF6
A.4S + 6NaOH(đặc)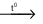 2Na2S + Na2S2O3+ 3H2O
2Na2S + Na2S2O3+ 3H2O
C.S + Hg → HgS
D.S + 6HNO3 (đặc) 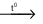 H2SO4+ 6NO2+ 2H2O
H2SO4+ 6NO2+ 2H2O
Ứng dụng nào sau đây khôngphải của ozon?
A.Điều chế oxi trong phòng thí nghiệm.
B.Sát trùng nước sinh hoạt.
C.Chữa sâu răng.
D.Tẩy trắng tinh bột, dầu ăn.
Chọn câu đúng khi nói về flo, clo, brom, iot?
A.Brom có tính oxi hóa mạnh, tuy yếu hơn flo và clo nhưng nó cũng oxi hóa được nước.
B.Iot có tính oxi hóa yếu hơn flo, clo, brom nhưng nó cũng oxi hóa được nước.
C.Flo có tính oxi hóa rất mạnh, oxi hóa mãnh liệt nước.
D.Clo có tính oxi hóa mạnh, oxi hóa được nước.
Phát biểu nào sau đây là sai?
A.Tính axit của HF mạnh hơn tính axit của HCl.
B.Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo.
C.Độ âm điện của brom lớn hơn độ âm điện của iot.
D.Tính khử của ion Br mạnh hơn tính khử của ion Cl
mạnh hơn tính khử của ion Cl .
.
Phương pháp nào sau đây khôngdùng để điều chế oxi trong phòng thí nghiệm?
A.Phân hủy kali pemanganat.
B.Phân hủy kali nitrat.
C.Điện phân nước.
D.Phân hủy kali clorat.
Phản ứng được dùng để sản xuất SO2trong công nghiệp là:
A.4FeS2+ 11O2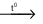 8SO2+ 2Fe2O3
8SO2+ 2Fe2O3
B.Cu + 2H2SO4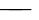 SO2+ CuSO4+ 2H2O
SO2+ CuSO4+ 2H2O
C.3S + 2KClO3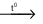 3SO2+ 2KCl
3SO2+ 2KCl
D.C + 2H2SO4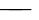 2SO2+ CO2+ 2H2O
2SO2+ CO2+ 2H2O
Trường hợp nào sau đây khôngxảy ra phản ứng hóa học?
A.Sục khí H2S vào dung dịch CuCl2.
B.Cho Fe vào dung dịch H2SO4loãng, nguội.
C.Sục khí H2S vào dung dịch FeCl2.
D.Sục khí Cl2vào dung dịch FeCl2.
Đổ dung dịch AgNO3vào dung dịch muối nào sau đây sẽ khôngthấy tạo kết tủa?
A.NaBr.
B.NaCl.
C.NaF.
D.NaI.
Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu. Khí X là
A.NH3.
B.O3.
C.CO2.
D.SO2.
Tính chất hóa học đặc trưng của oxi là
A.tính oxi hóa yếu.
B.vừa có tính oxi hóa, vừa có tính khử.
C.tính oxi hóa mạnh.
D.tính khử mạnh.
Dẫn khí SO2vào dung dịch H2S, hiện tượng xảy ra là
A.dung dịch chuyển sang màu nâu đen.
B.dung dịch bị vẩn đục màu vàng rồi lại trong suốt.
C.tạo thành chất rắn màu đỏ.
D.dung dịch bị vẩn đục màu vàng.
Trong số các axit halogenhiđric, axit có lực axit mạnh nhất là
A.HBr.
B.HF.
C.HCl.
D.HI.
Dung dịch axit nào sau đây khôngbảo quản được trong bình thủy tinh?
A.HNO3.
B.HCl.
C.H2SO4.
D.HF.
Trong phản ứng nào sau đây, chất tham gia phản ứng nhất thiết phải là axit H2SO4đặc, nóng ?
A.6H2SO4+ 2Al 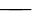 Al2(SO4)3+ 6H2O + 3SO2
Al2(SO4)3+ 6H2O + 3SO2
B.H2SO4+ Na2CO3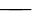 Na2SO4+ CO2+ H2O
Na2SO4+ CO2+ H2O
C.H2SO4+ Zn 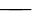 ZnSO4+ H2
ZnSO4+ H2
D.H2SO4+ Fe(OH)2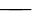 FeSO4+ 2H2O
FeSO4+ 2H2O
Nhận định nào sau đây khôngđúng ?
A.Để điều chế được 2,24 lít khí Cl2(ở đktc) với hiệu suất phản ứng là 80% thì cần một lượng dung dịch axit clohiđric đặc có chứa ít nhất 0,25 mol HCl.
B.Để hoà tan hết 5,6 gam Fe cần một lượng vừa đủ dung dịch có chứa 0,2 mol HCl.
C.Dung dịch axit clohiđric đặc tác dụng với MnO2(không cần đun nóng) tạo ra khí clo.
D.Axit clohiđric hoà tan được Al, Zn, CaCO3, BaSO3, đồng thời giải phóng ra chất khí không màu.
Hấp thụ hoàn toàn 6,72 lít khí SO2(đktc) vào 500 ml dung dịch NaOH 0,9 M. Khối lượng muối thu được sau phản ứng là
A.15,6 gam.
B.37,8 gam.
C.18,9 gam.
D.34,5 gam.
Hòa tan hoàn toàn 1,53 gam hỗn hợp kim loại Mg, Al và Zn trong dung dịch HCl dư thấy thoát ra 448 ml khí (đktc). Cô cạn dung dịch thu được chất rắn có khối lượng là
A.2,14 gam.
B.1,85 gam.
C.2,95 gam.
D.3,90 gam.
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, HClO3, MnO2lần lượt phản ứng với lượng dư dung dịch HCl đặc ở điều kiện thích hợp, chất tạo ra lượng khí Cl2nhiều nhất là
A.HClO3.
B.MnO2.
C.CaOCl2.
D.KMnO4.
Cho cân bằng hóa học sau: 2SO2(k) + O2(k) ⇄ 2SO3(k) ; ∆H < 0 và các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2>O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp làm cân bằng trên chuyển dịch theo chiều thuận là
A.(2), (3), (5).
B.(1), (2), (4).
C.(1), (2), (4), (5).
D.(2), (3), (4), (6).
1 lít dung dịch hỗn hợp X gồm HCl và H2SO4tác dụng với dung dịch BaCl2dư thu được 23,3 gam kết tủa và dung dịch Y. Trung hoà Y cần 0,5 lít dung dịch NaOH 1M. Nồng độ mol của HCl và H2SO4trong dung dịch X lần lượt là
A.0,5M và 0,1M.
B.0,4M và 0,1M.
C.0,3M và 0,1M.
D.0,3M và 0,4M.
Đun nóng 11,2 gam bột sắt với 9,6 gam bột lưu huỳnh trong điều kiện không có không khí thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư được khí Y. Hấp thụ hết Y vào dung dịch Pb(NO3)2được m gam kết tủa. Giá trị lớn nhất của m là
A.51,0.
B.47,8.
C.13,9.
D.71,7.
Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2và O2phản ứng vừa đủ với 22,2 gam hỗn Y gồm Mg và Al thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A.24,32%.
B.48,65%.
C.51,35%.
D.75,68%.
Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hoà tan hết X vào H2SO4đặc, nóng, dư thoát ra 0,84 lít khí SO2(là sản phẩm khử duy nhất, đo ở đktc). Giá trị của m là
A.2,52.
B.0,70.
C.1,68.
D.2,80.


