28 CÂU HỎI
Theo dãy: HF, HCl, HBr, HI thì
A. Tính axit giảm, tính khử giảm.
B. Tính axit tăng, tính khử giảm.
C. Tính axit giảm, tính khử tăng.
D. Tính axit tăng, tính khử tăng.
Cho các mệnh đề sau:
(a) Các halogen đều có số oxi hóa dương
(b) Halogen đứng trước thì đẩy được halogen đứng sau ra khỏi dung dịch muối.
(c) Các halogen đều tan được trong nước.
(d) Các halogen đều tác dụng được với hidro.
Số mệnh đề phát biểu sailà.
A. 3.
B. 4.
C. 1.
D. 2.
Trong phòng thí nghiệm, H2S được điều chế từ các hóa chất nào dưới đây?
A. FeS + HCl.
B. H2+ S.
C. Zn + H2SO4đặc, nóng.
D. CuS + H2SO4.
Để điều chế SO2trong phòng thí nghiệm người ta tiến hành như sau:
A. Cho dung dịch Na2SO3+ dung dịch H2SO4đặc.
B. Đốt cháy hoàn toàn khí H2S trong không khí.
C. Cho Na2SO3tinh thể + dung dịch H2SO4(đun nóng).
D. Cho lưu huỳnh cháy trong không khí.
Cho dung dịch chứa 1g HBr vào dung dịch chứa 1g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu nào?
A. Đỏ.
B. Xanh.
C. Không xác định.
D. Không đổi màu.
Phương pháp được dùng để pha loãng dung dịch H2SO4đặc trong phòng thí nghiệm là
A. cho từ từ axit vào nước và khuấy đều.
B. cho từ từ nước vào axit và khuấy đều.
C. cho nhanh nước vào axit và khuấy đều.
D. cho nhanh axit vào nước và khuấy đều.
Có các phương trình phản ứng sau
(1) 2KI + O3+ H2O → I2+ 2KOH + O2
(2) 5nH2O + 6nCO2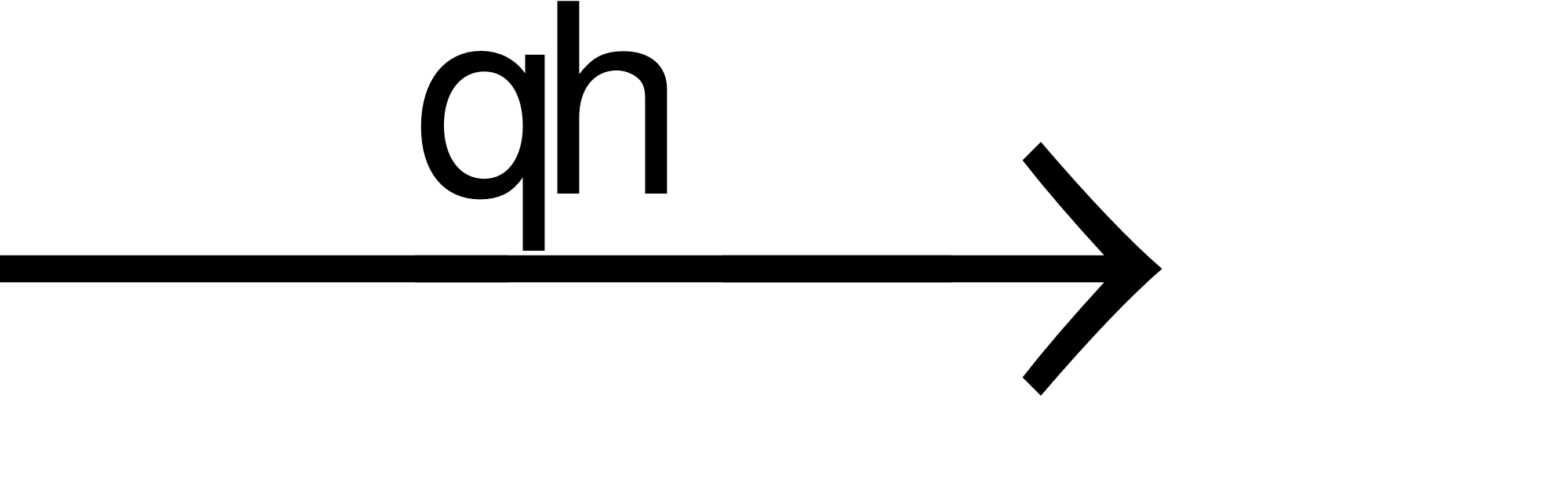 (C6H10O5)n+ 6nO2
(C6H10O5)n+ 6nO2
(3) 2H2O 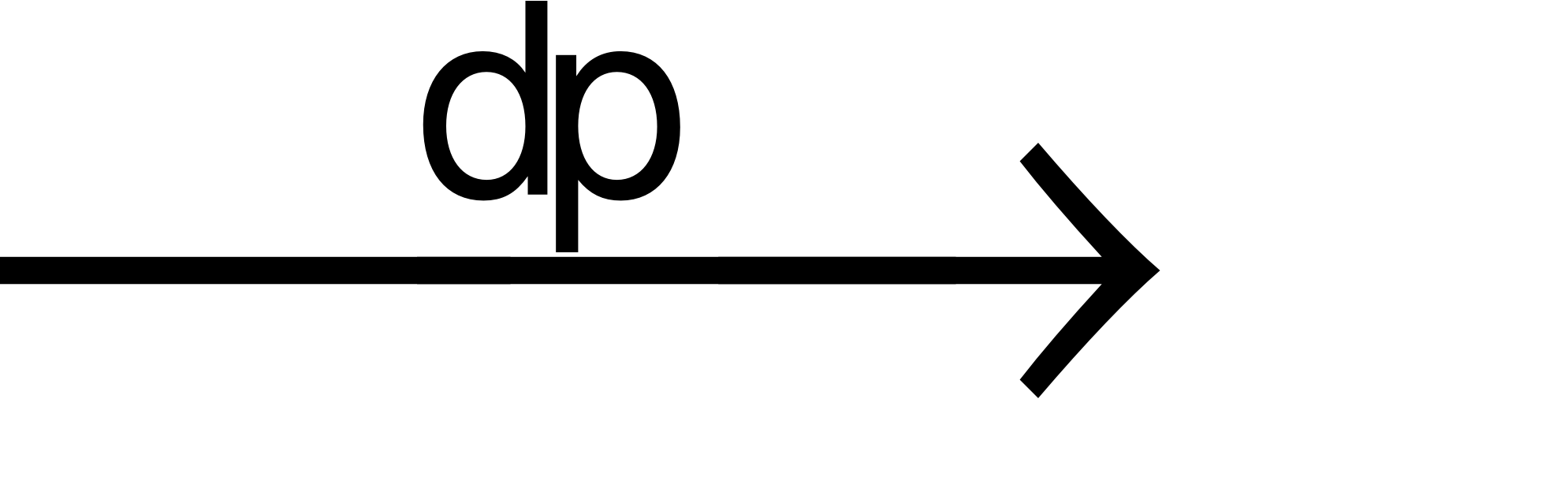 2H2+ O2
2H2+ O2
(4) 2KMnO4→ K2MnO4+ MnO2+ O2
Số phương trình dùng để điều chế oxi trong phòng thí nghiệm là
A. 2.
B. 1.
C. 4.
D. 3.
Trong công nghiệp, axit sunfuric được sản xuất theo sơ đồ nào?
A. S → H2S → SO2→ H2SO4.
B. FeS2→ SO2→ H2S → H2SO4.
C. FeS2→ S → SO2→ SO3→ H2SO4.
D. S → SO2→ SO3→ H2SO4.
Trong phòng thí nghiệm, khí clo được điều chế bằng cách khử hợp chất nào sau đây?
A. H2SO4.
B. NaCl.
C. KMnO4.
D. HCl.
Dung dịch nào sau đây không thể chứa trong bình thủy tinh
A. HF.
B. HBr.
C. HI.
D. HCl.
Cho một mảnh giấy quì tím vào dung dịch NaOH loãng. Sau đó sục khí Cl2vào dung dịch đó, hiện tượng xảy ra là
A. Giấy quì từ màu tím chuyển sang màu xanh.
B. Giấy quì từ màu xanh chuyển sang không màu.
C. Giấy quì từ màu xanh chuyển sang màu hồng.
D. Giấy quì từ màu xanh chuyển sang màu tím.
Tính chất hóa học cơ bản của các nguyên tử nhóm halogen là
A. tính khử mạnh.
B. tính oxi hóa yếu.
C. tính khử yếu.
D. tính oxi hóa mạnh.
Hóa chất được dùng để nhận biết dung dịch chứa muối clorua là
A. NaNO3.
B. NaCl.
C. AgCl.
D. AgNO3.
Chỉ dùng một thuốc thử nào sau đây để phân biệt các dung dịch NH4Cl, FeCl3, MgBr2, CuBr2là
A. NaOH.
B. Ba(NO3)2.
C. NaCl.
D. AgNO3.
Dãy kim loại phản ứng được với H2SO4loãng là
A. Ag, Ba, Fe.
B. Cu, Zn, Na.
C. Mg, Fe, Zn.
D. Au, Pt, Al.
Trong y tế đơn chất halogen nào hòa tan trong etanol được dùng làm chất sát trùng
A. I2.
B. F2.
C. Cl2.
D. Br2.
Câu nào sau đây đúng?
A. Tất cả các muối AgX (X là halogen) đều không tan.
B. Các hidro halogenua tác dụng trực tiếp với hầu hết các kim loại.
C. Các hidro halogenua ở điều kiện thường đều là chất khí, dễ tan trong nước thành các dung dịch axit mạnh.
D. Tính axit của các axit HX tăng từ HF đến HI.
Dãy các dung dịch có tính axit giảm dần là
A. H2S >H2CO3 >HCl.
B. H2S >HCl >H2CO3.
C. HCl >H2S >H2CO3.
D. HCl >H2CO3 >H2S.
Chọn phát biểu sai
A. H2SO4vừa có tính oxi hóa, vừa có tính khử.
B. SO2 vừa có tính oxi hóa, vừa có tính khử.
C. SO3chỉ thể hiện tính oxi hóa.
D. H2S chỉ thể hiện tính khử.
Trong các halogen, chất ít tan trong nước nhất là chất
A. I2.
B. Br2.
C. Cl2.
D. F2.
Một cân bằng hóa học đạt được khi
A. nồng độ chất phản ứng bằng nồng độ của sản phẩm.
B. phản ứng không xảy ra nữa dù có thêm tác động của các yếu tố bên ngoài như: nhiệt độ, nồng độ, áp suất.
C. nhiệt độ phản ứng không đổi.
D. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Số electron lớp ngoài cùng của các nguyên tử nhóm halogen là
A. 4.
B. 7.
C. 6.
D. 5.
Công thức của clorua vôi là
A. CaOCl2.
B. Ca2OCl.
C. CaO2Cl.
D. CaOCl.
Trong các nguyên tử nhóm halogen, chất ở trạng thái lỏng là
A. Br2.
B. F2.
C. I2.
D. Cl2.
Kim loại nào sau đây khi tác dụng với dung dịch HCl và khí clo đều cho cùng một loại muối
A. Cu.
B. Zn.
C. Ag.
D. Fe.
Cho sơ đồ phản ứng: H2SO4 đặc,nóng+ Fe → Fe2(SO4)3+ SO2+ H2O.
Số phân tử H2SO4 bị khử và số phân tử H2SO4tham gia tạo muối trong phương trình phản ứng trên là
A. 6 và 3.
B. 6 và 6.
C. 3 và 3.
D. 2 và 3.
Tổng hệ số (là số nguyên tối giản) của các chất trong phương trình phản ứng sau là bao nhiêu?
HCl + KMnO4→ MnCl2+ Cl2+ KCl + H2O
A. 36.
B. 33.
C. 34.
D. 35.
Kim loại nào dưới đây thụ động trong H2SO4đặc?
A. Cu, Fe.
B. Al, Fe.
C. Zn, Fe.
D. Zn, Al.


