18 CÂU HỎI
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử?
A. ![]()
B. ![]()
C. HF.
D. ![]()
Liên kết hóa học là
A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Liên kết σ là liên kết được hình thành do
A. sự xen phủ bên của 2 orbital.
B. cặp electron chung.
C. lực hút tĩnh điện giữa hai ion.
D. sự xen phủ trục của hai orbital.
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 1 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
A. (Z = 12).
B. (Z = 9).
C. (Z = 11).
D. (Z = 10).
Cho bảng số liệu sau:
|
Chất |
Nước ( |
Hydrogen sulfide ( |
|
Nhiệt độ sôi ( |
100,0 |
- 60,7 |
Phát biểu nào sau đây sai?
A. Liên kết O – H trong phân tử ![]() kém phân cực hơn liên kết S – H trong phân tử
kém phân cực hơn liên kết S – H trong phân tử ![]()
B. Số liên kết trong phân tử ![]() bằng số liên kết trong phân tử
bằng số liên kết trong phân tử ![]()
C. Trong phân tử ![]() và phân tử
và phân tử ![]() chỉ có các liên kết cộng hóa trị.
chỉ có các liên kết cộng hóa trị.
D. Do có liên kết hydrogen giữa các phân tử nên nước có nhiệt độ sôi cao hơn hydrogen sulfide.
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Trong phân tử HF, số cặp electron dùng chung và cặp electron hóa trị riêng của nguyên tử F lần lượt là
A. 1 và 4.
B. 1 và 3.
C. 3 và 1.
D. 2 và 2.
Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình bền vững?
A. Nhận 5 electron, nhường 5 electron.
B. Nhận 3 electron, nhường 3 electron.
C. Nhường 3 electron, nhận 3 electron.
D. Nhường 5 electron, nhận 5 electron.
Trong phân tử carbon dioxide (CO2) số liên kết σ và liên kết π lần lượt là
A. 4 và 0.
B. 3 và 1.
C. 2 và 2.
D. 0 và 4.
Cho các hình biểu diễn sự xen phủ orbital nguyên tử để tạo liên kết hóa học sau:
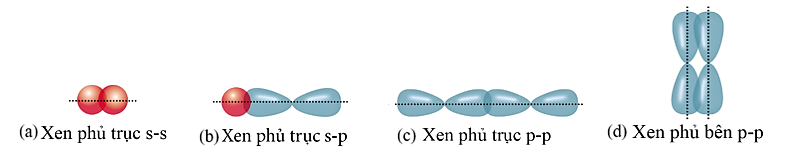
Biết số hiệu các nguyên tử của H, F và S lần lượt là 1, 9 và 16. Sự tạo thành liên kết trong các phân tử ![]() và
và ![]() theo kiểu xen phủ tương ứng là
theo kiểu xen phủ tương ứng là
A. (b) và (c).
B. (a) và (c).
C. (c) và (d).
D. (b) và (d).
Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
A. Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
B. Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
C. Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
D. Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.
Liên kết ion có bản chất là
A. sự dùng chung các electron.
B. lực hút tĩnh điện của các ion mang điện tích trái dấu.
C. lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. lực hút giữa các phân tử.
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
A. helium.
B. argon.
C. krypton
D. neon.
Cho các phân tử: ![]() Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
A. 6.
B. 5.
C. 4.
D. 3.
Hợp chất trong phân tử có liên kết ion là
A. ![]()
B. ![]()
C. HCl.
D. ![]()
Cho các phát biểu sau về các loại liên kết:
(a) Liên kết ion mạnh hơn liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết cộng hóa trị.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Số phát biểu không đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Phát biểu nào sau đây là không đúng?
A. Liên kết σ có thể tạo thành từ sự xen phủ trục của hai AO khác loại.
B. Liên kết σ bền vững hơn liên kết π.
C. Các AO p không có khả năng xen phủ tạo liên kết σ.
D. Các AO s chỉ có khả năng xen phủ tạo liên kết σ.
Magnesium oxide thường được sử dụng để lót bên trong các lò công nghiệp vì có nhiệt độ nóng chảy cao. Loại liên kết hay tương tác hóa học trong magnesium oxide là
A. tương tác van der Waals.
B. liên kết ion.
C. liên kết cộng hóa trị.
D. liên kết hydrogen.

