60 CÂU HỎI
Chủ đề 9. NITROGEN VÀ SULFUR
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Trong tự nhiên, đơn chất nitrogen có nhiều trong
A. nước biển.
B. không khí.
C. cơ thể người.
D. mỏ khoáng.
Diêu tiêu Chile (hay diêm tiêu natri) là tên gọi khác của hợp chất nào sau đây?
A. Sodium chloride.
B. Potassium sulfate.
C. Sodium nitrate.
D. Potassium nitrate.
Vị trí của nguyên tố N (Z = 7) trong bảng tuần hoàn các nguyên tố hóa học là
A. ô số 7, chu kì 3, nhóm VA.
B. ô số 3, chu kì 2, nhóm VIA.
C. ô số 7, chu kì 2, nhóm VIA.
D. ô số 7, chu kì 2, nhóm VA.
Đặc điểm cấu tạo của phân tử N2 là
A. có 1 liên kết ba.
B. có 1 liên kết đôi.
C. có 2 liên kết đôi.
D. có 2 liên kết ba.
Trong hợp chất nitrogen có các mức oxi hóa nào sau đây?
A. -3, +3, +5
B. -3, 0, +3, +5.
C. -3, +1, +2, +3, +4, +5.
D. -3, 0, +1, +2, +3, +4, +5.
Tính chất nào sau đây không phải tính chất vật lí của N2?
A. Chất khí.
B. Không màu.
C. Nặng hơn không khí.
D. Tan ít trong nước.
Trong phản ứng: N2(g) + 3H2(g) ![]() 2NH3(g). N2 thể hiện
2NH3(g). N2 thể hiện
A. tính khử.
B. tính oxi hóa.
C. tính base.
D. tính acid.
Trong phản ứng: N2(g) + O2(g) ![]() 2NO(g). N2 thể hiện
2NO(g). N2 thể hiện
A. tính khử.
B. tính oxi hóa.
C. tính base.
D. tính acid.
Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Khí nitrogen ít tan trong nước là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Liên kết hoá học trong phần tử NH3 là liên kết
A. cộng hoá trị có cực.
B. ion.
C. cộng hoá trị không cực.
D. kim loại.
Dạng hình học của phân tử ammonia là
A. hình tam giác đều.
B. hình tứ diện.
C. đường thẳng.
D. hình chóp tam giác.
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
A. màu hồng.
B. màu vàng.
C. màu đỏ.
D. màu xanh.
Tính chất hóa học của NH3 là
A. tính base, tính khử.
B. tính base, tính oxi hóa.
C. tính acid, tính base.
D. tính acid, tính khử.
Dung dịch NH3 phản ứng được với dung dịch nào sau đây?
A. NaOH.
B. KCl.
C. HCl.
D. KOH
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây làm bột nở?
A. (NH4)2SO4.
B. NH4HCO3.
C. CaCO3.
D. NH4NO2.
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
A. NH3.
B. H2.
C. NO2
D. NO.
Phương trình hóa học nào sau đây sai?
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein.
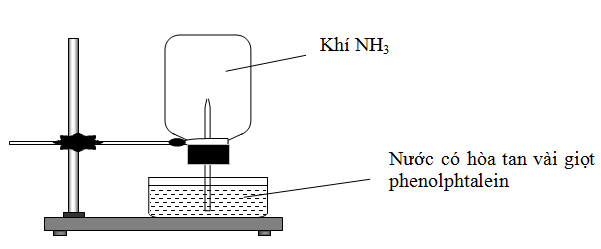
Hiện tượng xảy ra trong thí nghiệm là
A. Nước phun vào bình và chuyển thành màu hồng.
B. Nước phun vào bình và chuyển thành màu tím.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu xanh.
Có thể dùng chất nào sau đây để làm khô khí ammonia?
A. Dung dịch H2SO4 đặc.
B. P2O5 khan.
C. MgO khan.
D. CaO khan.
Oxide phổ biến của nitrogen trong không khí là
A. NO, N2O.
B. NO, NO2.
C. N2O3, NO2.
D. NO, N2O4.
Nitrogen dioxide là tên gọi của oxide nào sau đây?
A. NO.
B. NO2.
C. N2O.
D. N2O4.
Mưa acid là hiện tượng tượng nước mưa có pH như thế nào?
A. > 5,6.
B. < 7.
C. > 7.
D. < 5,6.
Tác nhân chính gây ra hiện tượng mưa acid là
A. CO, SO2.
B. NOx, SO2.
C. NH3, NO2.
D. CO, NH3.
Cho iron(III) oxide tác dụng với nitric acid thì sản phẩm thu được là
A. Fe(NO3)3, NO và H2O.
B. Fe(NO3)3, NO2 và H2O.
C. Fe(NO3)3, N2 và H2O.
D. Fe(NO3)3 và H2O.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng nào trong các nguồn nước?
A. N, C.
B. N, K.
C. N, P.
D. P, K.
Hoạt động nào sau đây góp phần gây nên hiện tượng phú dưỡng?
A. Sự quang hợp của cây xanh.
B. Nước thải sinh hoạt thải trực tiếp vào nguồn nước chưa qua xử lí.
C. Ao hồ thả quá nhiều tôm, cá.
D. Khử trùng ao hồ sau khi tát cạn bằng vôi sống (CaO).
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường chuyển sang màu vàng là do
A. HNO3 tan nhiều trong nước.
B. khi để lâu thì HNO3 bị khử bởi các chất của môi trường
C. dung dịch HNO3 có tính oxi hóa mạnh.
D. dung dịch HNO3 có hoà tan một lượng nhỏ NO2.
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Các hệ số a, b, c, d, e là những số nguyên tối giản nhất. Tổng (a + b) bằng
A. 3.
B. 5.
C. 4.
D. 6.
Phản ứng giữa kim loại magie với nitric acid loãng giải phóng khí dinitrogen oxide. Tổng các hệ số trong phương trình hóa học bằng là
A. 10.
B. 18.
C. 24.
D. 20.
Chủ đề 9.2. Đơn chất sulfur và một số hợp chất của sulfur
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Cấu hình electron lớp ngoài cùng của nguyên tử sulfur là
A. 3s2 3p4.
B. 2s2 2p4.
C. 3s2 3p6.
D. 2s2 2p6.
Nguyên tố sulfur có số hiệu nguyên tử là 16. Vị trí của sulfur trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA.
B. chu kì 5, nhóm VIA
C. chu kì 3, nhóm IVA.
D. chu kì 5, nhóm IVA.
Các số oxi hóa thường gặp của sulfur là
A. -2; -1; 0; +4.
B. -2; 0; +4; +6.
C. 0; +4; +6; +8.
D. 0; +3; +5; +7.
Ở điều kiện thường, phân tử đơn chất sulfur gồm số nguyên tử là
A. 2.
B. 4.
C. 6.
D. 8.
Trong số các chất khí: SO2, H2, O2, NH3, khí tan trong nước tạo dung dịch acid là
A. O2.
B. H2.
C. SO2.
D. NH3.
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất nào sau đây?
A. Fe.
B. O2.
C. H2.
D. Hg.
Ở điều kiện thích hợp, sulfur dioxide đóng vai trò là chất oxi hóa khi tham gia phản ứng với chất nào sau đây?
A. NO2.
B. H2S.
C. NaOH.
D. Ca(OH)2.
Chất được dùng để tẩy trắng giấy và bột giấy trong công nghiệp là
A. N2O.
B. CO2.
C. SO2.
D. NO2.
Khí nào sau đây có khả năng làm mất màu nước bromine?
A. N2.
B. CO2.
C. H2.
D. SO2.
Thạch cao sống là một dạng tồn tại phổ biến của sulfur trong tự nhiên, được sử dụng làm nguyên liệu để sản xuất xi măng, phấn viết bảng, … Công thức của thạch cao sống là
A. BaSO4.
B. CaSO4.2H2O.
C. MgSO4.
D. CuSO4.5H2O.
Tính chất nào sau đây không phải tính chất vật lí của sulfur?
A. Màu vàng ở điều kiện thường.
B. Thể rắn ở điều kiện thường.
C. Không tan trong benzene.
D. Không tan trong nước.
Khi nhiệt kế thủy ngân vỡ, rắc chất bột nào sau đây lên thủy ngân rơi vãi sẽ chuyển hóa chúng thành hợp chất bền, ít độc hại?
A. Than đá.
B. Đá vôi.
C. Muối ăn.
D. Sulfur.
Sau khi điều chế, khí SO2 có lẫn hơi nước được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ sau:
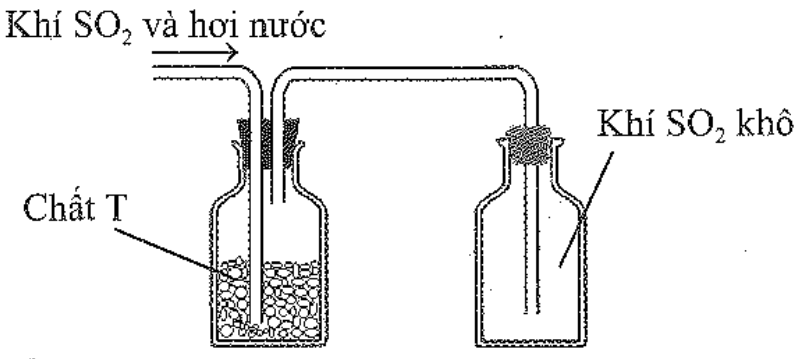
Chất T có thể là
A. KOH.
B. NaOH.
C. CaO.
D. P2O5.
Chất nào sau đây không bay hơi ở điều kiện thường do nhiệt độ sôi rất cao (337 oC)?
A. H2O.
B. ![]()
C. NH3.
D. ![]()
Quá trình pha loãng dung dịch đậm đặc của acid nào sau đây tỏa rất nhiều nhiệt nên không được tự ý pha loãng ?
A. HCl.
B. ![]()
C. CH3COOH.
D. ![]()
Ở thể lỏng, chất nào sau đây có dạng sánh như dầu do tồn tại liên kết hydrogen rất mạnh giữa các phân tử?
A. ![]()
B. ![]()
C. H2O.
D. CH3COOH.
Cách pha loãng dung dịch H2SO4 đặc nào sau đây đúng?
A. Rót nhanh acid vào nước và khuấy đều.
B. Rót nhanh nước vào acid và khuấy đều.
C. Rót từ từ nước vào acid và khuấy đều.
D. Rót từ từ acid vào nước và khuấy đều.
Trong công nghiệp sản suất sulfuric acid, sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc tạo thành oleum có công thức chung là
A. ![]()
B. ![]()
C. ![]()
D. (SO3)n.
Trong các chất sau, chất nào phản ứng được với dung dịch H2SO4 loãng?
A. CuS.
B. FeS.
C. S.
D. Cu.
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A. Al.
B. Zn.
C. Na.
D. Cu.
Các khí sinh ra trong thí nghiệm phản ứng của saccharose (C12H22O11) với dung dịch H2SO4 đặc bao gồm:
A. H2S và CO2.
B. H2S và SO2.
C. SO3 và CO2.
D. SO2 và CO2.
Dung dịch sulfuric acid đặc khác dung dịch sulfuric acid loãng ở tính chất hóa học nào?
A. Tính base mạnh.
B. Tính oxi hóa mạnh.
C. Tính acid mạnh.
D. Tính khử mạnh.
Trong công nghiệp, hydrogen fluoride được điều chế từ quặng fluorite theo phản ứng: ![]() . Vai trò của sulfuric acid trong phản ứng là
. Vai trò của sulfuric acid trong phản ứng là
A. base.
B. chất oxi hóa.
C. acid.
D. chất khử.
Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc?
A. Tính háo nước.
B. Tính oxi hóa.
C. Tính acid.
D. Tính khử.
Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
A. Ba(OH)2.
B. BaCl2.
C. Ba(NO3)2.
D. MgCl2.
Muối X không tan trong nước và các dung môi hữu cơ. Trong y học, X thường được dùng làm chất cản quang xét nghiệm X-quang đường tiêu hóa. Công thức của X là
A. BaSO4.
B. Na2SO4.
C. K2SO4.
D. MgSO4.
Cho phản ứng: S + 2H2SO4 ![]() 3SO2 + 2H2O. Tỉ lệ giữa số nguyên tử sulfur bị khử và số nguyên tử sulfur bị oxi hoá là
3SO2 + 2H2O. Tỉ lệ giữa số nguyên tử sulfur bị khử và số nguyên tử sulfur bị oxi hoá là
A. 1: 2.
B. 1: 3.
C. 3: 1.
D. 2: 1.
Trong công nghiệm sản xuất sulfuric acid, hai nguồn nguyên liệu được khai thác từ mỏ để cung cấp nguyên tố sulfur là
A. ZnS, PbS.
B. H2S, SO2.
C. CaSO4, BaSO4.
D. S, FeS2.
Khi trộn dung dịch Na2SO4 với dung dịch BaCl2, phản ứng thực chất xảy ra trong dung dịch là
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Cho các nguyên liệu sau: sulfur, quặng pyrite (FeS2), không khí, nước, vanadium (V)oxide (V2O5). Số nguyên liệu được sử dụng trong công nghiệp sản xuất sulfuric acid là
A. 4.
B. 2.
C. 5.
D. 3.

