(Trả lời ngắn) 25 bài tập Hóa 10 Kết nối tri thức Bài 19: Tốc độ phản ứng hóa học (có lời giải)
25 câu hỏi
Có mấy yếu tố ảnh hưởng đến tốc độ phản ứng?
Hãy sắp xếp tốc độ các phản ứng sau theo chiều tăng dần: (1) phản ứng than cháy trong không khí, (2) phản ứng gỉ sắt, (3) phản ứng nổ của khí bình gas.
Thực hiện phản ứng: 2ICl + H2 ![]() I2 + 2HCl. Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
I2 + 2HCl. Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
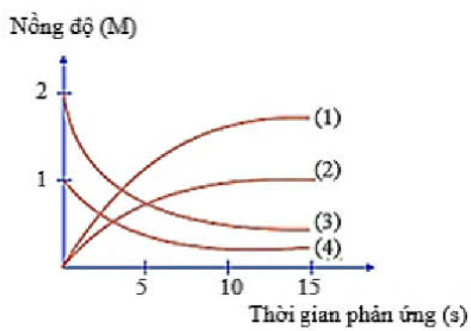
Đường cong biểu diễn sự thay đổi nồng độ của ICl là đường cong số mấy?
Cho các phản ứng hóa học sau:
(1) CH3COOC2H5(l) + H2O(l) ![]() CH3COOH(l) + C2H5OH(l).
CH3COOH(l) + C2H5OH(l).
(2) Zn(s) + H2SO4(aq) ![]() ZnSO4(aq) + H2(g).
ZnSO4(aq) + H2(g).
(3) H2C2O4(aq) + 2KMnO4(aq) + 8H2SO4(aq) ![]() 10CO2(g) + 2MnSO4(aq) + 8H2O(l).
10CO2(g) + 2MnSO4(aq) + 8H2O(l).
Liệt kê theo số thứ tự tăng dần trường hợp giảm tốc độ phản ứng khi thêm nước vào bình phản ứng.
Cho các phản ứng hóa học sau:
(a) Fe3O4(s) + 4CO(g) ![]() 3Fe(s) + 4CO2(g)
3Fe(s) + 4CO2(g)
(b) 2NO2(g) ![]() N2O4(g)
N2O4(g)
(c) H2(g) + Cl2(g) ![]() 2HCl(g)
2HCl(g)
(d) CaO(s) + SiO2(s) ![]() CaSiO3(s)
CaSiO3(s)
(e) CaO(s) + CO2(g) ![]() CaCO3(s)
CaCO3(s)
(g) 2KI(aq) + H2O(aq) ![]() I2(s) + 2KOH(aq)
I2(s) + 2KOH(aq)
Có bao nhiêu phản ứng thay đổi tốc độ khi áp suất thay đổi?
Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid:
4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g)
Có các biện pháp sau: (1) Tăng áp suất; (2) Giảm nồng độ các chất tham gia phản ứng; (3) Tăng nhiệt độ; (4) Sử dụng chất xúc tác Pt.
Liệt kê các biện pháp làm tăng tốc độ phản ứng theo dãy số thứ tự tăng dần.
Năm 1785, một vụ nổ xảy ra tại một nhà kho nhà Giacomelli (Roma, Italia) làm nghề nghiền bột mi. Sau khi điều tra, nguyên nhân ban đầu dẫn đến vụ nổ là do bột mì khô. Sự cố xảy ra khi bột mì bay trong không khí, chạm tới nguồn lửa của chiếc đèn, đây là vụ nổ đầu tiên trong lịch sử. Sau đó là các vụ nổ bụi trong hầm than, xưởng sản xuất sữa bột, dược phẩm, nhựa, kim loại,… có tác nhân tương tự gồm: nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín.
Bột mì trên đĩa hay tập trung một chỗ thì rất khó cháy, nếu được phun tơi dạng bụi sẽ dễ cháy hơn, là do bề mặt tiếp xúc tăng lên rất nhiều. Khi đủ các tác nhân: nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt đc vụ nổ và không gian đủ kín sẽ gây ra thứ nổ cấp (nổ dây chuyền). Để ngăn ngừa và hạn chế nổ bụi, có thể can thiệp vào các yếu tố nào?
(1) Giảm nồng độ bụi.
(2) Kiểm soát nguồn nhiệt trong khu vực sản xuất (hệ thống điện, nguồn điện, ổ cắm.).
(3) Đóng kín các cửa công xưởng để giảm lượng không khí lưu thông.
(4) Giữ cho nhà xưởng luôn thông thoáng.
Liệt kê đáp án đúng theo dãy số thứ tự tăng dần (Ví dụ: 1234, 24,...).
Khí oxygen (O2) được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate (KClO3). Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Dùng chất xúc tác manganes dioxide (MnO2).
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Đập nhỏ potassium chlorate.
Liệt kê biện pháp dùng để tăng tốc độ phản ứng theo số thứ tự tăng dần.
Khi nghiên cứu ảnh hưởng của nhiệt độ tới tốc độ của phản ứng giữa Mg(s) với HCl(aq), cho những mô tả sau:
(1) Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng.
(2) Khi đun nóng, bọt khí thoát ra chậm hơn so với không đun nóng.
(3) Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng.
(4) Khi đun nóng, dây Mg tan chậm hơn so với không đun nóng.
Liệt kê số mô tả phản ánh đúng hiện tượng quan sát được khi làm thí nghiệm theo số thứ tự tăng dần.
Cho các quá trình xảy ra như sau
(a) Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
(b) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanke (trong sản xuất xi măng).
(c) Rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn,…) để ủ rượu.
(d) Tạo những lỗ rỗng trong viên than tổ ong.
Có tất cả bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng trong các quá trình trên?
Cho các trường hợp sau:
(a) Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự cháy diễn ra mạnh hơn.
(b) Phản ứng oxi hoá SO2 thành SO3 diễn ra nhanh hơn khi có mặt của V2O5.
(c) Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
(d) Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn.
(e) Sử dụng nồi áp suất để hầm thức ăn giúp thức ăn nhanh chín.
(g) Sử dụng các loại men thích hợp để làm sữa chua, lên men rượu, giấm,…
Tổng số trường hợp bị ảnh hưởng bởi nhiệt độ và chất xúc tác là bao nhiêu?
Sulfuric acid (H2SO4) là hóa chất quan trọng trong công nghiệp, ứng dụng trong sản xuất phân bón, lọc dầu, xử lí nước thải, Một giai đoạn để sản xuất H2SO4 là phản ứng: 2SO2(g) + O2(g) ![]() 2SO3(g), kết quả thực nghiệm của phản ứng cho giá trị theo bảng:
2SO3(g), kết quả thực nghiệm của phản ứng cho giá trị theo bảng:
Thời gian (s) | SO2 (M) | O2 (M) | SO3 (M) |
300 | 0,0270 | 0,0500 | 0,0072 |
720 | 0,0194 | 0,0462 | 0,0148 |
Tốc độ trung bình của phản ứng trong khoảng thời gian trên là x.10–6 M/s. Giá trị của x là bao nhiêu?
Phương trình tổng hợp amonia (NH3): N2(g) + 3H2(g) ![]() 2NH3(g). Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ phản ứng của H2 là bao nhiêu M/s? (Làm tròn kết quả đến hàng phần trăm).
2NH3(g). Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ phản ứng của H2 là bao nhiêu M/s? (Làm tròn kết quả đến hàng phần trăm).
Thả một mảnh magnesium có khối lượng 0,1 g vào dung dịch HCl loãng. Sau 5 giây thấy mảnh magnesium tan hết. Tốc độ trung bình của phản ứng hòa tan magnesium theo đơn vị g/s là bao nhiêu?
Trong một thí nghiệm, người ta đo được tốc độ trung bình của phản ứng của zinc (dạng bột) với dung dịch H2SO4 loãng là 0,005 mol/s. Nếu ban đầu cho 0,4 mol zinc (dạng bột) với dung dịch H2SO4 ở trên thì sau bao nhiêu giây còn lại 0,05 mol zinc.
Hai phương trình hóa học của phản ứng xảy ra với cùng một lượng Cl2 như sau:
Mg(s) + Cl2(g) ![]() MgCl2(s);(1)
MgCl2(s);(1)
2Na(s) + Cl2(g) ![]() 2NaCl(s);(2)
2NaCl(s);(2)
Sau 1 phút, khối lượng MgCl2 được tạo ra 2 gam. Nếu tốc độ trung bình xảy ra trong phản ứng (2) tương đương (1), thì khối lượng sản phẩm NaCl thu được là bao nhiêu gam? (Làm tròn kết quả đến hàng phần trăm).
Phản ứng phân huỷ ozone: 2O3(g) ![]() 3O2(g) có tốc độ trung bình của sự hình thành O2 là 1,5.10–3 M.s–1. Tính tốc độ trung bình của sự phân huỷ O3 bằng bao nhiêu mM/s?
3O2(g) có tốc độ trung bình của sự hình thành O2 là 1,5.10–3 M.s–1. Tính tốc độ trung bình của sự phân huỷ O3 bằng bao nhiêu mM/s?
Enzyme catalase phân huỷ hydrogen peroxide thành oxygen và nước nhanh gấp khoảng 107 lần sự phân huỷ khi không có xúc tác. Giả sử một phản ứng không có xúc tác phân huỷ một lượng hydrogen peroxide mất 360 ngày. Tính thời gian (theo giây) cho sự phân huỷ cùng một lượng hydrogen peroxide đó khi sử dụng enzyme catalase làm xúc tác? (Làm tròn kết quả đến hàng phần trăm).
Phản ứng giữa hai chất A và B được biểu thị bằng phương trình hóa học sau:
A + B ![]() 2C
2C
Tốc độ phản ứng này là v = k.[A].[B]. Thực hiện phản ứng này với sự khác nhau về nồng độ ban đầu của các chất:
- Trường hợp 1: Nồng độ của mỗi chất là 0,01 mol/L
- Trường hợp 2: Nồng độ của mỗi chất là 0,04 mol/L
Tốc độ ban đầu của phản ứng ở trường hợp 2 gấp bao nhiêu lần tốc độ ban đầu của phản ứng ở trường hợp 1?
Cho phản ứng đơn giản: H2 + I2 ![]() 2HI. Người ta thực hiện 3 thí nghiệm với nồng độ các chất đầu (
2HI. Người ta thực hiện 3 thí nghiệm với nồng độ các chất đầu (![]() và
và ![]() ) được lấy khác nhau và xác định tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
) được lấy khác nhau và xác định tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
|
|
|
0,10 | 0,20 | 5,00 |
0,20 | 0,20 | 10,00 |
0,10 | 0,15 | 3,75 |
Hằng số tốc độ phản ứng k có giá trị bao nhiêu?
Xét phản ứng sau: 2ClO2 + 2NaOH ![]() NaClO3 + NaClO2 + H2O
NaClO3 + NaClO2 + H2O
Tốc độ phản ứng được viết như sau: ![]() . Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
. Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
TT | Nồng độ ClO2 (M) | Nồng độ NaOH (M) | Tốc độ phản ứng (mol/(L.s)) |
1 | 0,01 | 0,01 | 2.10–4 |
2 | 0,02 | 0,01 | 8.10–4 |
3 | 0,01 | 0,02 | 4.10–4 |
Tổng giá trị (x + y) là bao nhiêu?
Khi để ở nhiệt độ 30 °C, một quả táo bị hư sau 3 ngày. Khi được bảo quản ở 0 °C (trong tủ lạnh), quả táo bị hư sau 24 ngày. Nếu bảo quản ở 20 °C, quả táo bị hư sau bao nhiêu ngày?
Để hoà tan một tấm Zn trong dung dịch HCl ở 20 °C thì cần 27 phút, cũng tấm Zn đó tan hết trong dung dịch HCl nói trên ở 40 °C trong 3 phút. Hỏi để hoà tan hết tấm Zn đó trong dung dịch HCl trên ở 55 °C thì cần bao nhiêu thời gian (giây)? (Làm tròn kết quả đến hàng phần mười).
Khi nhiệt độ phòng là 25 °C, cho 10 g đá vôi (dạng viên) vào cốc đựng 100 g dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút. Lặp lại thí nghiệm khi nhiệt độ phòng là 35 °C. Kết quả thí nghiệm được ghi lại trong bảng sau:
TT | Nhiệt độ (oC) | Khối lượng cốc (g) | |
Thời điểm đầu | Sau 1 phút | ||
1 | 25 | 235,40 | 235,13 |
2 | 35 | 235,78 | 235,21 |
(a) Tính hệ số nhiệt độ của phản ứng. (Làm tròn kết quả đến hàng phần mười).![]()
(b) Giả sử ban đầu cốc chứa dung dịch HCl và đá vôi có khối lượng 235,40 g. Thực hiện thí nghiệm ở 45 °C. Hỏi sau 1 phút, khối lượng cốc là bao nhiêu? (Bỏ qua khối lượng nước bay hơi). (Làm tròn kết quả đến hàng đơn vị).
Chất độc màu da cam dioxin gây tác hại vô cùng nghiêm trọng đối với môi trường và sức khoẻ con người. Nó phân huỷ vô cùng chậm trong đất. Nghiên cứu cho thấy phải mất tám năm để lượng dioxin trong đất giảm đi một nửa. Nếu một mảnh đất có chứa 0,128 mg dioxin thì sau bao lâu lượng dioxin còn lại là 10–6 g dioxin.








