Đề thi thử tốt nghiệp THPT môn Hóa học Sở GD và ĐT Quảng Bình ( lần 1) có đáp án
40 câu hỏi
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Trong thực tế, sử dụng cách nào sau đây để bảo vệ kim loại sắt khỏi bị ăn mòn ?
Gắn đồng với kim loại sắt.
Ngâm sắt trong dung dịch acid.
Phủ một lớp sơn lên bề mặt sắt.
Để trong không khí ẩm.
Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố potassium cho cây trồng do chứa muối potassium carbonate. Công thức của potassium carbonate là :
KCl.
KOH.
KHCO3.
K2CO3.
Polypropylene có công thức là :
(-CH2-CHCl-)n.
(-CH2-CCl=CH-CH2-)n.
(-CH2-CH(CH3)-)n.
(-CH2-CH=CH-CH2-)n.
Thành phần nào sau đây không có trong mạng tinh thể kim loại ?
Ion kim loại.
Nguyên tử kim loại.
Electron.
Anion.
Quá trình sản xuất soda bằng phương pháp Solvay không sử dụng nguyên liệu nào sau đây ?
Carbon dioxide.
Muối ăn.
Sodium hydroxide.
Ammonia.
Ion Ca2+ (Z = 20) đóng vai trò thiết yếu trong việc phát triển xương, giúp duy trì hoạt động của cơ bắp, kích thích máu lưu thông, điều tiết một số loại hormone,. Tổng số proton và electron trong một ion Ca2+ là :
40.
42.
38.
18.
Theo quy định, tất cả các loại chất lỏng, tinh dầu được coi là chất lỏng dễ cháy và là hàng hoá nguy hiểm nếu có điểm chớp cháy nhỏ hơn 60°C không được vận chuyển qua đường hàng không. Cho điểm chớp cháy của một số loại tinh dầu thường gặp như sau :
Tinh dầu | Trầm hương | Quế | Đinh hương | Tràm gió | Oải hương | Thông |
Điểm chớp cháy (°C) | 51 | 87 | 87 | 52 | 68 | 65 |
Trong các tinh dầu trên, theo quy định có bao nhiêu tinh dầu hành khách không được phép mang theo lên máy bay ?
2.
4.
5.
6.
Phân đạm cung cấp nguyên tố nitrogen cho cây trồng ở dạng ammonium, nitrate. Độ dinh dưỡng của phân đạm được tính bằng phần trăm khối lượng của nguyên tố nitrogen có trong loại phân bón đó. Loại phân đạm nào sau đây có độ dinh dưỡng thấp nhất ?
(NH4)2SO4.
CO(NH2)2.
NH4NO3.
NH4Cl.
Kết quả phân tích phổ khối lượng (MS) cho thấy phân tử khối của hợp chất hữu cơ X là 59. Chất X có thể là
acetic acid.
acetone.
vinyl formate.
trimethylamine.
Phản ứng nào sau đây được gọi là phản ứng ester hóa ?
Thủy phân ester trong môi trường kiềm.
Thủy phân ester trong môi trường acid.
Phản ứng điều chế ester từ carboxylic acid và alcohol.
Phản ứng hydrogen hóa chất béo chứa gốc acid không no.
Hợp chất CH3CH2NH2 có tên thay thế là
ethylamine.
methylamine.
N-methylmethanamine.
ethanamine.
Chất nào sau đây thuộc loại polysaccharide?
Maltose.
Glucose.
Fructose.
Amylose.
Phương trình hóa học của phản ứng nitro hóa benzene để tạo thành nitrobenzene là: C6H6 + HNO3 (H2SO4) → C6H5NO2 + H2O
Giai đoạn (2) trong cơ chế của phản ứng trên xảy ra như sau:
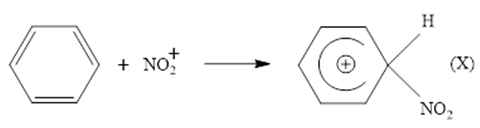
Nhận định nào sau đây không đúng?
Phản ứng nitro hóa benzene là phản ứng thế.
Trong giai đoạn (2) ở trên có sự hình thành liên kết σ.
Trong phân tử benzene có 12 liên kết σ.
X có cùng công thức phân tử với nitrobenzene.
Công thức cấu tạo thu gọn của ethyl ethanoate là
HCOOCH3.
CH3COOCH3.
CH3COOCH2CH3.
CH3CH2COOCH2CH3.
“Peptide là những hợp chất hữu cơ được cấu tạo từ các đơn vị … (1) … liên kết với nhau qua liên kết … (2) … ”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
α-amino acid, peptide (-CO-NH-).
β-amino acid, amide (-CO-NH-).
α-amino acid, amide (-CO-NH-).
β-amino acid, peptide (-CO-NH-).
Glutamic acid là một trong những amino acid không thiết yếu đối với cơ thể con người. Với mỗi môi trường có giá trị pH bằng 1,0; 3,2; 12,0, coi glutamic acid chỉ tồn tại ở dạng cho dưới đây:
Trong quá trình điện di, ion sẽ di chuyển về phía điện cực trái dấu với ion. Cho các nhận định sau về quá trình điện di của glutamic acid:
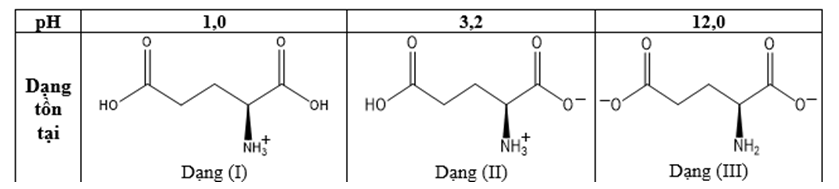
(a) Với môi trường pH = 1,0 thì dạng (I) di chuyển về cực âm.
(b) Với môi trường pH = 3,2 thì dạng (II) hầu như không dịch chuyển về các điện cực.
(c) Với môi trường pH = 12,0 thì dạng (III) di chuyển về cực âm.
(d) Với môi trường pH = 1,0 thì dạng (I) hầu như không dịch chuyển về các điện cực.
Các nhận định đúng là
(a), (b).
(b), (c).
(b), (d).
(c), (d).
Cho phản ứng hoá học: Cu + 2Fe3+ → Cu2+ + 2Fe2+. Phát biểu nào sau đây về phản ứng trên không đúng?
Cu bị Fe3+ oxi hoá thành Cu2+.
Cu2+ có tính oxi hoá mạnh hơn Fe3+.
Fe3+ bị Cu khử thành Fe2+.
Cu là chất khử, Fe3+ là chất oxi hoá.
Pin điện hóa có thể ký hiệu đơn giản: kim loại 1 (anode) - kim loại 2 (cathode). Cho sức điện động chuẩn của các pin điện hoá sau: E°Cu-X = 0,46V; E°Y-Cu = 2,71V; E°Z-Cu = 0,78V (với X, Y, Z là ba kim loại). Dãy sắp xếp các kim loại X, Y, Z theo chiều tăng dần tính khử là
X, Y, Z.
X, Z, Y.
Y, Z, X.
Z, X, Y.
a) Tại anode xảy ra quá trình oxi hoá Al3+.
b) Cryolite không bị điện phân trong thùng điện phân.
c) Năng lượng điện tiêu thụ để sản xuất được 1 kg Al theo lí thuyết là 14 kWh (đã làm tròn đến hàng đơn vị).
d) Bên cạnh nhôm, oxygen tinh khiết cũng thu được trực tiếp từ quy trình này.
a) Phản ứng tổng hợp aspirin là phản ứng ester hóa.
b) Sử dụng phương pháp chiết để tách aspirin ra khỏi hỗn hợp sau phản ứng.
c) 1 mol aspirin tác dụng tối đa với 3 mol NaOH trong dung dịch.
d) Để tổng hợp aspirin đủ sản xuất 1 triệu viên “aspirin 81” cần dùng ít nhất 621 gam salicylic acid.
a) Ở bước 3, dung dịch iodine chuyển sang màu xanh tím nghĩa là tinh bột chưa thủy phân hết.
b) Theo số liệu phản ứng, phản ứng thủy phân tinh bột ở 40°C diễn ra nhanh hơn ở 50°C.
c) Ở nhiệt độ bằng nhiệt độ cơ thể (37°C), tốc độ phản ứng thủy phân tinh bột nhờ xúc tác enzyme amylase trên xảy ra nhanh nhất.
d) Kết quả thí nghiệm chứng minh giả thuyết nghiên cứu ở trên của nhóm học sinh trong khoảng từ 20°C đến 70°C là sai.
a) Ở bước 2, cả ba ống nghiệm đều có khí thoát ra.
b) Tốc độ khí thoát ra ở ống nghiệm (2) nhanh hơn ở ống nghiệm (1).
c) Ở bước 2, nếu thêm tiếp 5 mL dung dịch H2SO4 1 M (loãng) vào cả 3 ống nghiệm thì tốc độ thoát khí ở cả ba ống nghiệm sẽ tăng lên.
d) Ở bước 1, nếu thay dung dịch H2SO4 0,5 M bằng dung dịch H2SO4 98% (đặc) thì sau bước 2, hiện tượng ở các ống nghiệm giống như dùng dung dịch H2SO4 0,5M.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng zinc blende thu được sản phẩm phụ là SO2 theo sơ đồ phản ứng: ZnS + O2 → ZnO + SO2.
Đốt cháy 1 tấn quặng zinc blende (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m³ khí SO2 (đkc). Tính giá trị của V (làm tròn đến hàng đơn vị).
Khi sử dụng xà phòng trong nước cứng, sẽ có phản ứng tạo thành kết tủa chứa calcium oleate ((C17H33COO)2Ca). Phân tử khối của calcium oleate là bao nhiêu?
Thủy phân một tripeptide X (mạch hở) thu được hỗn hợp glycine, alanine (có tỉ lệ số mol 2 : 1). Có bao nhiêu đồng phân cấu tạo của X thỏa mãn tính chất trên?
Tiến hành ghi phổ hồng ngoại (IR) một hợp chất có công thức phân tử C3H6O2 thu được kết quả như sau:
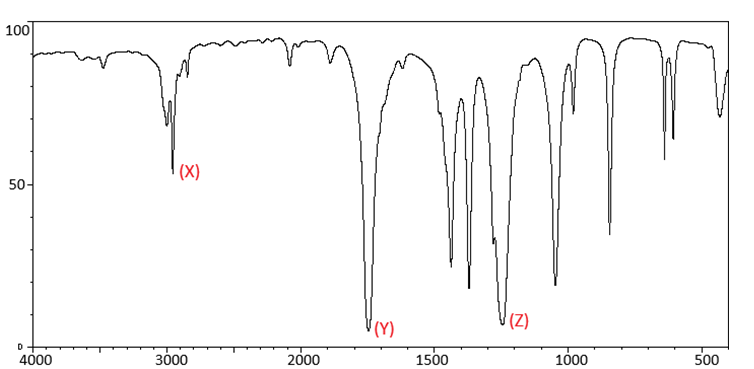
Số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số liên kết như sau:
Thứ tự | Liên kết | Số sóng (cm-1) |
1 | O-H (alcohol) | 3500 - 3200 (tù) |
2 | O-H (carboxylic) | 3300 - 3000 (tù rộng) |
3 | C-H | 3000 - 2840 |
4 | C=O (aldehyde, ketone, ester, carboxylic) | 1780 - 1650 |
5 | C-O (ether, ester, carboxylic) | 1300 - 1000 |
Gán số thứ tự tương ứng với liên kết đã cho ở bảng trên lần lượt theo các tín hiệu (peak): (X), (Y), (Z) ở phổ hồng ngoại trên thành dãy 3 chữ số. (Ví dụ : 123; 543; 512…).
Phản ứng nhiệt nhôm tỏa rất nhiều nhiệt nên có thể làm nóng chảy kim loại sinh ra sau phản ứng. Người ta dùng hỗn hợp gồm Al và Fe3O4 (hỗn hợp thermite) để hàn đường ray tàu hỏa, phản ứng sinh ra sắt ở dạng nóng chảy nên lượng sắt này dùng để hàn gắn đường ray và Al2O3 sinh ra nổi lên trên bảo vệ bề mặt trong lúc hàn, hạn chế sự oxi hóa sắt.
Cho biết Δf (Al2O3(s)) = -1675,7 kJ/mol; Δf (Fe3O4(s)) = -1121,0 kJ/mol.
Khi cho 45,6 gam hỗn hợp Al và Fe3O4 (có tỉ lệ số mol tương ứng 8 : 3) phản ứng hoàn toàn thì lượng nhiệt toả ra bằng bao nhiêu kJ? (làm tròn đến hàng đơn vị).
Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O bị oxi hóa bởi oxygen trong không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan hoàn toàn X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với dung dịch Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25,0 mL dung dịch Y, thu được 6,99 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25,0 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 30,0 mL. Tính phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng phần mười).








