Đề thi thử tốt nghiệp THPT môn Hóa học KSCL - THPT Khoái Châu- Hưng Yên- Lần 2 có đáp án
40 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Chất dẻo nào sau đây chứa chlorine?
PE.
PVC.
PPF.
PS.
Glucides (carbohydrate) là những hợp chất hữu cơ tạp chức có công thức chung là
CnH2nO
CxHyOz
R(OH)x(CHO)y.
Cn(H2O)m
Quá trình lưu hoá cao su thuộc loại phản ứng nào sau đây?
Tăng mạch polymer.
Giữ nguyên mạch polymer.
Cắt mạch polymer.
Phân huỷ polymer.
Chất nào sau đây thuộc loại disaccharide?
Cellulose.
Fructose.
Saccharose.
Glucose.
Công dụng quan trọng nhất của xà phòng là
Làm đẹp.
Làm nhiên liệu.
Tẩy rửa.
Chất phụ gia.
Cho = 0,597V và . Thế điện cực chuẩn của cặp oxi hoá – khử Ni2+/Ni là
-0,357 V.
0,257V.
0,357 V.
-0,257 V.
Cho mô hình phân tử hai hydrocarbon X và Y như sau:
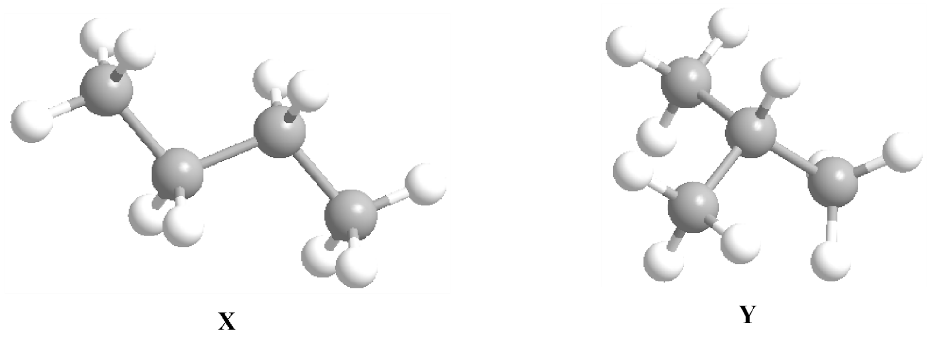
Cho các phát biểu sau:
(1) X, Y là đồng phân cấu tạo của nhau.
(2) X có nhiệt độ sôi cao hơn Y.
(3) Y có mạch carbon không phân nhánh.
(4) Cả X và Y đều chứa 13 liên kết sigma (σ).
Số phát biểu đúng là
2.
3.
4.
1.
Hợp chất X có công thức cấu tạo: CH3OCOCH2CH3. Tên gọi của X là
Methyl acetate.
Methyl propionate.
Propyl acetate.
Ethyl acetate.
Hình dưới đây mô tả tính chất vật lí nào của kim loại? (hình tròn to mô tả ion kim loại, hình tròn nhỏ mô tả electron tự do)
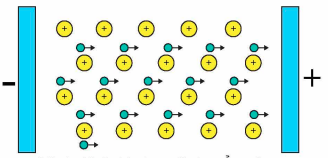
Tính dẻo.
Tính dẫn điện.
Tính cứng.
Tính dẫn nhiệt.
Sự đổi màu của hoa cẩm tú cầu đã tạo nên vẻ đẹp kì diệu của loài hoa này. Màu của loài hoa này có thể thay đổi tùy thuộc vào pH của đất trồng nên có thể điều chỉnh màu hoa thông qua việc điều chỉnh độ pH của đất
pH đất trồng | < 7 | = 7 | > 7 |
Màu của hoa | Lam | Trắng sữa | Hồng |
Khi trồng loài hoa trên, nếu ta bón thêm đạm 2 lá (NH4NO3) và chỉ tưới nước thì khi thu hoạch hoa sẽ có màu
Trắng sữa.
Hồng pha trắng sữa.
Lam.
Hồng.
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
Cặp oxi hóa- khử | Fe2+/Fe | Cu2+/Cu | Zn2+/Zn | Ag+/Ag | Pb2+/Pb |
Thế điện cực chuẩn (V) | -0,44 | +0,34 | -0,762 | +0,799 | -0,126 |
Trong các ion kim loại Fe2+, Zn2+, Cu2+, ở điều kiện chuẩn ion nào có tính oxi hóa mạnh hơn Pb2+ và yếu hơn Ag+?
Fe2+, Cu2+, Zn2+.
Zn2+.
Cu2+.
Fe2+, Cu2+.
Hợp chất alcohol, phenol có nhóm chức
–O–.
–COOH.
–NH2.
–OH.
Số đồng phân amine có công thức phân tử C2H7N là
3.
4.
2.
5.
Alanine và glutamic acid lần lượt tồn tại trong môi trường pH như sau:
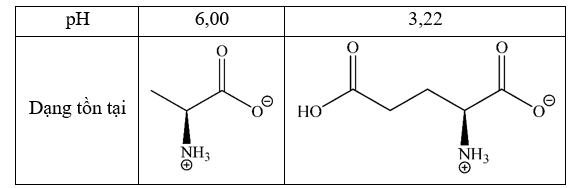
Cho các nhận định sau:
(a) Trong môi trường pH = 10, glutamic acid bị di chuyển về phía cực âm của điện trường.
(b) Trong môi trường pH = 10, alanine tồn tại chủ yếu dưới dạng anion.
(c) Trong môi trường pH = 6, glutamic acid tồn tại dưới dạng cation.
(d) Trong môi trường pH = 2, alanine bị di chuyển về phía cực dương của điện trường.
Số nhận định đúng là
4.
3.
1.
2.
Có 4 hợp chất hữu cơ propanoic acid, butan-1-ol, methyl acetate, methyl formate được kí hiệu ngẫu nhiên là X, Y, Z, T. Nhiệt độ sôi của 4 chất được cho ở bảng sau:
Chất | X | Y | Z | T |
Nhiệt độ sôi (0C) | 118 | 141 | 32 | 57 |
Nhận xét nào sau đây là đúng?
Y là methyl formate.
Z là butan- 1- ol.
X là propanoic acid.
T là methyl acetate.
Có 4 hợp chất hữu cơ propanoic acid, butan-1-ol, methyl acetate, methyl formate được kí hiệu ngẫu nhiên là X, Y, Z, T. Nhiệt độ sôi của 4 chất được cho ở bảng sau:
Chất | X | Y | Z | T |
Nhiệt độ sôi (0C) | 118 | 141 | 32 | 57 |
Nhận xét nào sau đây là đúng?
Y là methyl formate.
Z là butan- 1- ol.
X là propanoic acid.
T là methyl acetate.
Cho dãy các nguyên tố có cấu hình electron nguyên tử sau đây: Na: [Ne]3s1; Cr: [Ar]3d54s1; Br: [Ar]3d104s24p5; F: 1s22s22p5; Cu: [Ar]3d104s1. Số nguyên tố thuộc khối nguyên tố d là
3.
2.
1.
4.
Cho các vật liệu polymer: (1) tơ olon; (2) tơ capron; (3) quả bông; (4) tơ nylon-6,6, (5) tơ tằm. Khi đun nóng, số vật liệu bị thủy phân trong cả môi trường acid và môi trường base là
2.
3.
4.
1.
a) Khi điện phân xảy ra ở sơ đồ (2), nồng độ ion Cu2+ trong dung dịch sẽ giảm dần theo thời gian.
b) Khi điện phân xảy ra ở sơ đồ (1), thì ban đầu ở cực âm xảy ra quá trình oxi hóa ion Cu2+ và ở cực dương xảy ra quá trình khử H2O.
c) Trong sơ đồ (1), điện cực âm được gọi là anode và điện cực dương gọi là cathode.
d) Muốn tinh luyện Cu như sơ đồ (2) thì khối Cu có độ tinh khiết thấp được nối vào anode, còn thanh đồng mỏng có độ tinh khiết cao được nối vào cathode, khi đó khối lượng Cu tan ra từ anode bằng khối lượng Cu bám vào cathode.
a) X có công thức phân tử (C6H10O5)n, mỗi mắt xích của X chứa 5 nhóm –OH.
b) Chất Y có phản ứng lên men tạo thành ethanol hoặc lactic acid.
c) Chất X có khả năng phản ứng với methanol khi có mặt HCl khan làm xúc tác.
d) Ethanol có thể được sản xuất từ carbohydrate X. Loại ethanol này được dùng để sản xuất xăng E5 (chứa 5% ethanol về thể tích). Lượng ethanol thu được từ 1 tấn mùn cưa (chứa 81% chất X, phần còn lại là chất trơ) có thể pha chế được 9200 lít xăng E5. Biết hiệu suất quá trình sản xuất ethanol từ X là 80% và ethanol có khối lượng riêng là 0,8 gam/mL.
a) Albumin là protein dạng sợi, không tan trong nước nên ban đầu dung dịch bị đục.
b) Pepsin hoạt động tốt nhất ở pH = 2.
c) Từ kết quả thí nghiệm thì enzyme pepsin và chymotrypsin đều hoạt động tốt trong môi trường acid.
d) Ở ống nghiệm 3, nếu thay Pepsin thành Chymotrypsin thì hiện tượng quan sát được là “từ đục thành trong” sau thí nghiệm.
a) X là ethyl alcohol.
b) Tổng số nguyên tử trong phân tử E là 19.
c) Y có nhóm –OH và –COOH.
d) Nếu lấy 1 mol E tác dụng NaOH thì số mol NaOH cần để phản ứng vừa đủ là 3 mol.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Khi tiêu thụ các loại thực phẩm và đồ uống thì carbohydrate, protein và chất béo sẽ cung cấp năng lượng cho cơ thể. Hình bên là nhãn thực phẩm trên một loại coffee đóng chai. Dưới đây là giá trị nhiên liệu của một số chất có trong chai coffee. Giá trị nhiên liệu là năng lượng giải phóng khi đốt cháy hoàn toàn 1 gam chất.

Chất | Giá trị nhiên liệu (kJ/g) |
Carbohydrate | 17 |
Protein | 17 |
Chất béo | 38 |
Giả sử, trong quá trình làm việc, một người tiêu thụ trung bình 7 kJ năng lượng mỗi phút thì hoạt động này có thể được duy trì trong bao nhiêu phút từ năng lượng thu được từ một khẩu phần coffee đóng chai? (Kết quả làm tròn đến hàng đơn vị)
Cho các chất sau: C15H31COONa; C15H31COOK; CH3[CH2]11OSO3Na; CH3[CH2]11C6H4SO3Na; C17H33COOK. Có bao nhiêu chất là thành phần chính của chất giặt rửa tổng hợp?
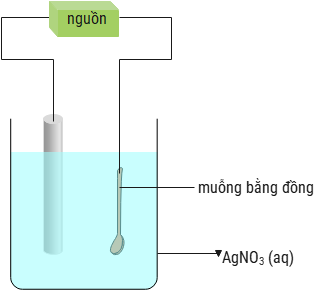
Mạ điện là một trong những ứng dụng của điện phân dựa trên định luật Faraday. Sơ đồ ở bên minh họa một bình điện phân được sử dụng để mạ bạc cho muỗng bằng đồng. Tính khối lượng kim loại bạc tạo thành phủ lên muỗng bằng đồng khi dùng dòng điện 2,1A trong 45 phút để mạ điện thìa đồng với hiệu suất là 80% (làm tròn đáp án đến hàng phần mười).
Một học sinh thực hiện các thí nghiệm để kiểm tra tính chất hóa học của ethylamine (C2H5NH2) và thu được các kết quả sau:
Thí nghiệm số 1: Dung dịch ethylamine làm phenolphtalein đổi màu hồng.
Thí nghiệm số 2: Nhỏ dung dịch ethylamine vào dung dịch FeCl3, thấy có kết tủa nâu đỏ xuất hiện.
Thí nghiệm số 3: Thêm vài giọt nước bromine vào dung dịch ethylamine, thấy có kết tủa trắng xuất hiện.
Thí nghiệm số 4: Dung dịch ethylamine tác dụng với HNO2 (ở nhiệt độ thường), thấy có khí thoát ra.
Đã có một thí nghiệm trên bị sai kết quả, hỏi đó là thí nghiệm số mấy?
Có 4 lọ mất nhãn (1), (2), (3), (4) chứa ngẫu nhiên các dung dịch ethanal, fructose, methanol, saccharose. Biết rằng:
+ dung dịch (1), (2) tác dụng với Cu(OH)2 trong môi trường kiềm ở điều kiện thường tạo dung dịch màu xanh thẫm.
+ dung dịch (2), (4) tác dụng với Cu(OH)2 trong môi trường kiềm khi đun nóng tạo kết tủa đỏ gạch.
Xác định thứ tự các chất ethanal, fructose, methanol, saccharose. (Học sinh ghi các số tương ứng với thứ tự các chất tìm được, ví dụ 1234, 4231, …).
Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Cl2 + 2KI 2KCl + I2.
- Lượng I2 sau đó được được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O32NaI + Na2S4O6.
Dựa vào thể tích dung dịch Na2S2O3 đã phản ứng, tính được lượng dư chlorine trong dung dịch mẫu.
Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01M thì thể tích Na2S2O3 đã dùng trong lần chuẩn độ lần lượt như sau:
Lần | 1 | 2 | 3 |
Thể tích Na2S2O3 đã dùng (mL) | 12,65 | 12,6 | 12,6 |
(dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại buret 25 mL, vạch chia 0,1 mL). Khối lượng Cl2 trong mẫu sản phẩm đã đem chuẩn độ ở trên là bao nhiêu mg? (Kết quả làm tròn đến hàng phần trăm).








