35 bài tập tổng hợp xác định biến thiên Enthalpy của phản ứng (có lời giải)
35 câu hỏi
Cho phương trình hóa học của phản ứng sau:
2H2(g) + O2(g) ![]() 2H2O(l) ∆H = –572 kJ
2H2O(l) ∆H = –572 kJ
Khi cho 2 gam khí H2 tác dụng hoàn toàn với 32 gam khí O2 thì phản ứng
tỏa ra nhiệt lượng 286 kJ.
thu vào nhiệt lượng 286 kJ.
tỏa ra nhiệt lượng 572 kJ.
thu vào nhiệt lượng 572 kJ.
Cho các phản ứng sau:
(1) C(s) + CO2(g) ![]() 2CO(g)
2CO(g) ![]() = 173,6 kJ
= 173,6 kJ
(2) C(s) + H2O(g) ![]() CO(g) + H2(g)
CO(g) + H2(g) ![]() = 133,8 kJ
= 133,8 kJ
(3) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
Ở 500 K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
–39,8 kJ.
39,8 kJ.
–47,00 kJ.
106,7 kJ.
Cho các phản ứng sau:
(1) 2H2S(g) + SO2(g) ![]() 2H2O(g) + 3S(s)
2H2O(g) + 3S(s) ![]() = –237 kJ
= –237 kJ
(2) 2H2S(g) + O2(g) ![]() 2H2O(g) + 2S(s)
2H2O(g) + 2S(s) ![]() = –530,5 kJ
= –530,5 kJ
Cùng một lượng hydrogen sulfide chuyển thành nước và sulfur thì tại sao nhiệt phản ứng (1) và (2) lại khác nhau.
Cho các phản ứng sau:
(1) 2H2S(g) + SO2(g) ![]() 2H2O(g) + 3S(s)
2H2O(g) + 3S(s) ![]() = –237 kJ
= –237 kJ
(2) 2H2S(g) + O2(g) ![]() 2H2O(g) + 2S(s)
2H2O(g) + 2S(s) ![]() = –530,5 kJ
= –530,5 kJ
Xác định ![]() của phản ứng: S(s) + O2(g)
của phản ứng: S(s) + O2(g) ![]() SO2(g) (3) từ 2 phản ứng trên.
SO2(g) (3) từ 2 phản ứng trên.
Tính biến thiên enthalpy theo các phương trình hóa học của các phản ứng sau, biết nhiệt sinh của NH3 bằng –46 kJ/mol.
N2(g) + 3H2(g) ![]() 2NH3(g) (1)
2NH3(g) (1)
1/2N2(g) + 3/2H2(g) ![]() NH3(g) (2)
NH3(g) (2)
So sánh ∆H (1) và ∆H (2). Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng tỏa ra hay thu vào là bao nhiêu? Tính theo hai phương trình phản ứng trên thì kết quả thu được giống nhau hay khác nhau.
Phản ứng đốt cháy ethanol: C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(g)
2CO2(g) + 3H2O(g)
Đốt cháy hoàn toàn 5 gam ethanol, nhiệt tỏa ra làm nóng chảy 447 gam nước đá ở 0 0C. Biết 1 gam nước đá nóng chảy hấp thụ nhiệt lượng 333,5 J, biến thiên enthalpy của phản ứng đốt cháy ethanol là
–1371 kJ/mol.
–954 kJ/mol.
–149 kJ/mol.
+ 149 kJ/mol
Phương trình nhiệt hóa học:
3H2(g) + N2(g) ![]() 2NH3(g)
2NH3(g) ![]() = –91,80 kJ
= –91,80 kJ
Lượng nhiệt tỏa ra khi dùng 9 gam H2(g) để tạo thành NH3(g) là
–275,40 kJ.
–137,70 kJ.
–45,90 kJ.
–183,60 kJ.
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
3Fe(s) + 4H2O(l) ![]() Fe3O4(s) + 4H2(g)
Fe3O4(s) + 4H2(g) ![]() = +26,32 kJ
= +26,32 kJ
Giá trị ![]() của phản ứng: Fe3O4(s) + 4H2(g)
của phản ứng: Fe3O4(s) + 4H2(g) ![]() 3Fe(s) + 4H2O(l) là
3Fe(s) + 4H2O(l) là
Biết rằng ở điều kiện chuẩn, 1 mol ethanol (C2H5OH) cháy tỏa ra một lượng nhiệt là 1,37.103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
0,450 kJ.
2,25.103 kJ.
4,50.102 kJ.
1,37.103 kJ.
Nhiệt tỏa ra khi đốt cháy 1 gam một mẫu than là 23,0 kJ. Giải thiết rằng toàn bộ lượng nhiệt của quá trình đốt than tỏa ra đều dùng để làm nóng nước, không có sự thất thoát nhiệt, hãy tính lượng than cần phải đốt để làm nóng 500 gam nước từ 20 0C tới 90 0C. Biết để làm nóng 1 mol nước thêm 1 0C cần một nhiệt lượng là 75,4 J.
Biết phản ứng đốt cháy khi carbon monoxide (CO) như sau:
CO(g) + 1/2O2(g) ![]() CO2(g)
CO2(g) ![]() = –851,5 kJ
= –851,5 kJ
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 lít khí CO thì nhiệt lượng tỏa ra là bao nhiêu?
Cho phản ứng:
2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g) ![]() = –285,66 kJ
= –285,66 kJ
Xác định giá trị của ![]() khi:
khi:
Lấy gấp 3 lần khối lượng của các chất phản ứng.
Cho phản ứng:
2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g) ![]() = –285,66 kJ
= –285,66 kJ
Xác định giá trị của ![]() khi:
khi:
Lấy một nửa khối lượng của các chất phản ứng.
Cho phản ứng:
2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g) ![]() = –285,66 kJ
= –285,66 kJ
Xác định giá trị của ![]() khi:
khi:
Đảo chiều của phản ứng.
Điều chế NH3 từ N2(g) và H2(g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Viết phương trình nhiệt hóa học của phản ứng tạo thành NH3, biết khi sử dụng 7 gam khí N2 sinh ra 22,95 kJ nhiệt.
Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxy hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
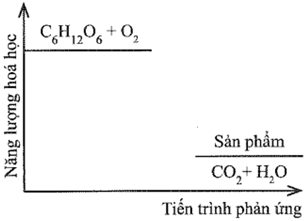
Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt. Vì sao?
Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxy hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
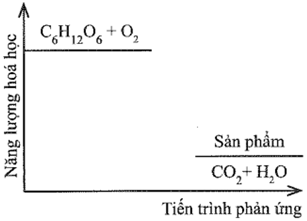
Viết PTHH của phản ứng thủy phân đường sucrose. Phản ứng trong sơ đồ có phải là phản ứng oxi hóa – khử hay không?
Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxy hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
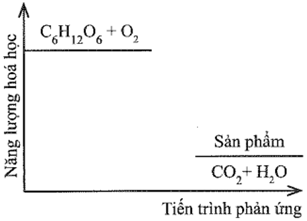 Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn tỏa ra một lượng nhiệt là 5645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hóa sucrose.
Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn tỏa ra một lượng nhiệt là 5645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hóa sucrose.
Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxy hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
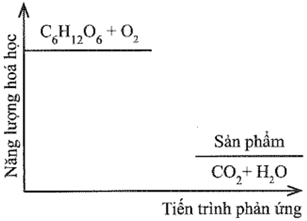 Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu?
Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu?
Cho các phản ứng
(1) CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g) ![]() = +178,49 kJ
= +178,49 kJ
(2) C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) ![]() = –1370,70 kJ
= –1370,70 kJ
(3) C(graphite, s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = –393,51 kJ
= –393,51 kJ
Phản ứng nào tự xảy ra (sau giai đoạn khơi mào ban đầu), phản ứng nào không thể tự xảy ra?
Cho các phản ứng
(1) CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g) ![]() = +178,49 kJ
= +178,49 kJ
(2) C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) ![]() = –1370,70 kJ
= –1370,70 kJ
(3) C(graphite, s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = –393,51 kJ
= –393,51 kJ
Khối lượng elthanol hay graphite cần dùng khi đốt cháy hoàn toàn đủ tạo lượng nhiệt cho quá trình nhiệt phân hoàn toàn 0,1 mol CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Lactic acid hay acid sữa là hợp chất hóa học đóng vai trò quan trọng trong nhiều quá trình sinh hóa, lần đầu tiên được phân tách vào năm 1780 bởi nhà hóa học Thụy Điển Carl Wilhelm Scheele. Lactic acid có công thức phân tử C3H6O3, công thức cấu tạo CH3–CH(OH)–COOH.
Khi vận động mạnh cơ thể không đủ cung cấp oxygen, thì cơ thể sẽ chuyển hóa glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể (lactic acid tạo thành từ quá trình này sẽ gây mỏi cơ) theo phương trình sau:
C6H12O6(aq) ![]() 2C3H6O3(aq)
2C3H6O3(aq) ![]() = –150 kJ
= –150 kJ
Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hóa glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng lactic acid tạo ra từ quá trình chuyển hóa đó (biết 1 cal = 4,184 J).
Cho phương trình nhiệt hóa học sau:
SO2(g) + 1/2O2(g) ![]() SO3(g)
SO3(g) ![]() = –98,5 kJ
= –98,5 kJ
Tính lượng nhiệt giải phóng ra khi chuyển 74,6 gam SO2 thành SO3.
Cho phương trình nhiệt hóa học sau:
SO2(g) + 1/2O2(g) ![]() SO3(g)
SO3(g) ![]() = –98,5 kJ
= –98,5 kJ
Giá trị ![]() của phản ứng: SO3(g)
của phản ứng: SO3(g) ![]() SO2(g) + 1/2O2(g) là bao nhiêu?
SO2(g) + 1/2O2(g) là bao nhiêu?
Cho các phương trình nhiệt hóa học sau:
2H2(g) + O2(g) ![]() 2H2O(l)
2H2O(l) ![]() = –571,68 kJ
= –571,68 kJ
1/2H2(g) + 1/2I2(g) ![]() HI(g)
HI(g) ![]() = 25,9 kJ
= 25,9 kJ
Xác định biến thiên enthalpy của 2 phản ứng sau:
H2(g) + 1/2O2(g) ![]() H2O(l)
H2O(l) ![]() =?
=?
HI(g) ![]() 1/2H2(g) + 1/2I2(g)
1/2H2(g) + 1/2I2(g) ![]() =?
=?
Xét quá trình đốt cháy khí propane [C3H8(g)]: C3H8(g) + 5O2 ![]() 3CO2(g) + 4H2O(g)
3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng phụ lục 2) và dựa vào năng lượng liên kết (Bảng phụ lục 1). So sánh hai giá trị đó và rút ra kết luận.
Phản ứng của glycerol với nitric acid (khử nước) tạo thành trinitroglycerin [C3H5O3(NO2)3]. Trinitroglycerin là một loại thuốc nổ, khi phân hủy tạo thành sản phẩm gồm có nitrogen, oxygen, carbon dioxide và hơi nước.
Viết PTHH của phản ứng điều chế trinitroglycerin từ glycerol với nitric acid và phản ứng phân hủy của trinitroglycerin.
Phản ứng của glycerol với nitric acid (khử nước) tạo thành trinitroglycerin [C3H5O3(NO2)3]. Trinitroglycerin là một loại thuốc nổ, khi phân hủy tạo thành sản phẩm gồm có nitrogen, oxygen, carbon dioxide và hơi nước.
Nếu phân hủy 45,4 gam trinitroglycerin, tính số mol khí và hơi tạo thành.
Phản ứng của glycerol với nitric acid (khử nước) tạo thành trinitroglycerin [C3H5O3(NO2)3]. Trinitroglycerin là một loại thuốc nổ, khi phân hủy tạo thành sản phẩm gồm có nitrogen, oxygen, carbon dioxide và hơi nước.
Khi phân hủy 1 mol trinitroglycerin tạo thành 1448 kJ nhiệt lượng. Tính lượng nhiệt tạo thành khi phân hủy 1 kg trinitroglycerin.
Cho các phương trình nhiệt hóa học của phản ứng:
a) 3H2(g) + 3/2O2(g) ![]() 3H2O(l)
3H2O(l) ![]() = –857,52 kJ
= –857,52 kJ
b) 2S(s) + 3O2(g) ![]() 2SO3(g)
2SO3(g) ![]() = +792,2 kJ
= +792,2 kJ
Ở điều kiện chuẩn nếu đốt cháy hoàn toàn 1,2 gam H2 (a) và 3,2 gam S (b) thì lượng nhiệt tỏa ra hay cần cung cấp là bao nhiêu?
Một mẫu cồn X (thành phần chính là ethanol) có lẫn methanol. Đốt cháy 10 gam X tỏa ra nhiệt lượng 291,9 kJ. Xác định thành phần % tạp chất methanol trong X, biết rằng:
CH3OH(l) + 3/2O2(g) ![]() CO2(g) + 2H2O(l) ∆H = –716 kJ/mol
CO2(g) + 2H2O(l) ∆H = –716 kJ/mol
C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(l) ∆H = –1370 kJ/mol
2CO2(g) + 3H2O(l) ∆H = –1370 kJ/mol
Glucose là một loại monosaccarit với công thức phân tử C6H12O6 được tạo ra bởi thực vật và hầu hết các loại tảo trong quá trình quang hợp từ nước và CO2, sử dụng năng lượng từ ánh sáng mặt trời. Dung dịch glucose 5% (D = 1,1 g/mL) là dung dịch đường tiêm tĩnh mạch, là loại thuốc thiết yếu, quan trọng của Tổ chức Y tế Thế giới (WHO) và hệ thống y tế cơ bản. Phương trình nhiệt hóa học của phản ứng oxi hóa glucose như sau:
C6H12O6(s) + 6O2(g) ![]() 6CO2(g) + 6H2O(l)
6CO2(g) + 6H2O(l) ![]() = –2803,0 kJ
= –2803,0 kJ
Tính năng lượng tối đa khi một người bệnh được truyền chai 500 mL dung dịch glucose 5%.
Khí gas chứa chủ yếu các thành phần chính: Propane (C3H8), butane (C4H10) và một số thành phần khác. Để tạo mùi cho gas nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng như methanthiol (CH3SH), có mùi giống tỏi, hành tây. Trong thành phần khí gas, tỉ lệ hòa trộn phổ biến của propane: butane theo thứ tự là 30: 70 đến 50: 50.
Mục đích việc pha trộn thêm chất tạo mùi đặc trưng vào khí gas là gì?
Khí gas chứa chủ yếu các thành phần chính: Propane (C3H8), butane (C4H10) và một số thành phần khác. Để tạo mùi cho gas nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng như methanthiol (CH3SH), có mùi giống tỏi, hành tây. Trong thành phần khí gas, tỉ lệ hòa trộn phổ biến của propane: butane theo thứ tự là 30: 70 đến 50: 50.
Cho các phương trình nhiệt hóa học sau:
C3H8(s) + 5O2(g) ![]() 3CO2(g) + 4H2O(l)
3CO2(g) + 4H2O(l) ![]() = –2220 kJ
= –2220 kJ
C4H10(s) + 13/2O2(g) ![]() 4CO2(g) + 5H2O(l)
4CO2(g) + 5H2O(l) ![]() = –2874 kJ
= –2874 kJ
Tính nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 bình gas 12 kg với tỉ lệ thể tích propane: butane là 30: 70 (thành phần khác không đáng kể) ở điều kiện chuẩn.
Khí gas chứa chủ yếu các thành phần chính: Propane (C3H8), butane (C4H10) và một số thành phần khác. Để tạo mùi cho gas nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng như methanthiol (CH3SH), có mùi giống tỏi, hành tây. Trong thành phần khí gas, tỉ lệ hòa trộn phổ biến của propane: butane theo thứ tự là 30: 70 đến 50: 50.
Giả sử một hộ gia đình cần 6000 kJ nhiệt mỗi ngày, sau bao nhiêu ngày sẽ sử dụng hết 1 bình gas (với hiệu suất hấp thụ nhiệt khoảng 60%).








